
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4 , 若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 .
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点.以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);△H=a kJmol﹣1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=﹣86.98kJmol﹣1
则a为 .
(3)如图表示使用新型电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式 . 生产中可分离出的物质A的化学式为 . 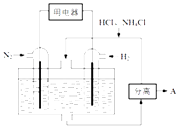
(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 使溶液中c(NH3H2O):c(NH4+)=5:9,此时溶液的pH= . (25℃时,NH3H2O的电离常数Kb=1.8×10﹣5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟严肃的质量分数为79.17%.请写出SiO2溶于氢氟酸的离子方程式
【答案】
(1)0.75mol
(2)+72.49
(3)N2+6e﹣+8H+=2NH4+;NH4Cl
(4)9
(5)SiO2+6HF=2H++SiF62﹣+2H2O
【解析】解:(1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到﹣3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若6molH3PO4生成,则参加反应CuSO4为6mol× ![]() =15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为
=15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为 ![]() =0.75mol,
=0.75mol,
所以答案是:0.75mol;(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJmol﹣1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=﹣86.98kJmol﹣1
依据热化学方程式和盖斯定律①+②=③,得到﹣159.47KJ/mol+a=﹣86.98KJ/mol
a=+72.49KJ/mol;
所以答案是:+72.49;(3)以N2、H2为原料,以HCl﹣NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+ , 电极反应式为N2+6e﹣+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液中可以分离出氯化铵;
所以答案是:N2+6e﹣+8H+=2NH4+; NH4Cl;(4)常温下,向0.1mol/L氨水中加入少许N2O5 , 五氧化二氮和0.1水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3H2ONH4++OH﹣ , 25℃时.NH3H2O的电离平衡常数Kb=1.8×10﹣5= 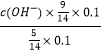 ,c(OH﹣)=10﹣5mol/L,c(H+)=10﹣9mol/L,PH=9,
,c(OH﹣)=10﹣5mol/L,c(H+)=10﹣9mol/L,PH=9,
所以答案是:9;(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy , 根据化合价代数和为0可知2+4x﹣y=0,由氟元素质量分数有 ![]() ×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6 , 故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62﹣+2H2O,所以答案是:SiO2+6HF=2H++SiF62﹣+2H2O.
×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6 , 故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62﹣+2H2O,所以答案是:SiO2+6HF=2H++SiF62﹣+2H2O.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按照要求将相应序号填入空白中:①35Cl②金刚石③CO④CO2⑤37Cl⑥ ![]() C⑦SO2⑧
C⑦SO2⑧ ![]() N⑨石墨
N⑨石墨
(1)互为同位素
(2)为酸性氧化物
(3)的质量数相等,但不能互为同位素
(4)互称同素异形体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,化学键类型和分子立体构型皆相同的是( )
A. CO2和SO2 B. CH4和SiCl4 C. BF3和PH3 D. HCl和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2分)一定温度下,可逆反应2NO2![]() 2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2;
②单位时间内生成n mol O2,同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝碱式酸盐[MgaAlb(OH)c(CO3)dxH2O]阻燃剂具有阻燃、消烟、填充等功能,是一种不溶于水的新型无机阻燃剂.
(1)将[MgaAlb(OH)c(CO3)dxH2O]表示成氧化物形式.
(2)为确定镁铝碱式碳酸盐的组成,进行如下实验:
准确称取15.050g样品进行灼烧至恒重,生成CO20.560L(已换算成标准状况下).分析测得残留物中MgO为6.000g,Al2O3为2.550g,通过计算确定该镁铝碱式碳酸盐的化学式 . (写出计算过程)
(3)该镁铝碱式碳酸盐可以由MgCl2、NaAlO2、NaOH和Na2CO3反应制备,制备的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不存在安全隐患的是
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.实验室做钠的实验时,余下的钠屑投入到废液缸中
C.制乙烯时,用量程为300 ℃的温度计代替量程为200 ℃的温度计,测反应液的温度
D.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) ![]() zC(g) △H<0。
zC(g) △H<0。
达到化学平衡后测得A的浓度为0.5 mol·L-1;在恒温下,将密闭容器的容积压缩至
原来的二分之一,再次达到平衡时,测得A的浓度为0.9 mol·L-1。则下列叙述中
正确的是( )
A. 平衡向正反应方向移动了 B. x+y<z
C. B的转化率下降 D. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ . 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl)≥0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+一定不存在,K+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com