
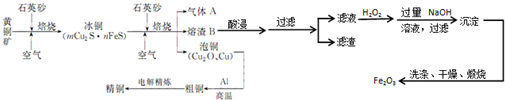
分析 流程分析:利用黄铜矿与石英砂、空气混合焙烧得到冰铜(mCu2S•nFeS),继续焙烧得到气体SO2(大气污染物需要用纯碱溶液吸收)、熔渣及泡铜,其中熔渣经过硫酸溶解过滤除去不溶于酸的SiO2和含有Fe2+、Fe3+、Al3+的酸性溶液,利用过量氢氧化钠溶液进行分离得到氢氧化铁沉淀,过滤洗涤灼烧得到氧化铁,泡铜与Al通过铝热反应得到粗铜,再利用电解得到精铜,据此分析解题;
(1)反应中化合价降低的元素被还原,CuFeS2中Cu元素化合价从+2价降为0价,Fe元素部分从+2价升高为+3价,S有-2价升高为+4价,可结合化合价升降总数判断电子转移数目;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;SO2有漂白性,能使品红褪色,但生成的无色物质不稳定;
(3)a、利用过氧化氢在酸性条件下的氧化性氧化溶液里的Fe2+,同时还原为水;
b、氢氧化铝是两性氧化物,能和强酸以及强碱反应;
(4)先选择酸溶解熔渣B,再利用亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色来选择试剂及方法.
解答 解:(1)化合价降低的元素Cu、O,在反应中被还原,根据反应方程式可知1molCuFeS2参与反应时,有$\frac{21}{8}$mol的氧气参与反应,同时得到1molCu,共转移电子的物质的量为$\frac{21}{8}×4mol+1mol×2$=12.5mol,
故答案为:Cu、O;12.5;
(2)冶炼过程产生大量SO2.分析下列处理方案:a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;d.用浓硫酸不能吸收二氧化硫,故d不合理;可将A气体先通入品红溶液里,若品红褪色,再加热,看能否恢复红色,从而判断气体是否是二氧化硫,
故答案为:b、c;将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫;
(3)a.酸性条件下过氧化氢氧化Fe2+的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
b.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++AI2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成四羟基合铝,
故答案为:Al3++4OH-=2H2O+AlO2-;
(4)用稀硫酸溶解熔渣B,在所得溶液中滴加高锰酸钾溶液,因高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣B所得溶液使KMnO4溶液褪色.
点评 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
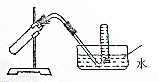 如图装置可用于( )
如图装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和稀HNO3反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用NaCl于浓H2SO4反应制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| B. | Fe2SO4$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2溶液$\stackrel{足量CO_{2}}{→}$Al(OH)3 | |
| D. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com