
����Ŀ����֪���Ϊ2L�ĺ����ܱ������з�����Ӧ��2SO2��g�� + O2��g��![]() 2SO3��g��������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
2SO3��g��������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
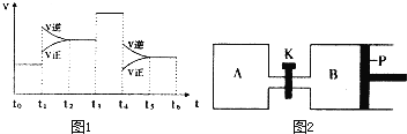
��1��һ�������£�����2mol SO2��g����2mol O2��g����20s���SO2������ٷֺ���Ϊ12.5%������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ_____________________��
��2���������������Ϊ�жϣ�1���п��淴Ӧ�ﵽƽ��״̬���ݵ��ǣ�����ţ�___________��
�����������ܶȲ��� ����������ƽ����Է�����������
�� v����SO2��=2v����O2�� ���������Ũ�ȶ����ٷ����仯
��3��ͼ1��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���ı仯�Ĺ�ϵ�������в�ͬʱ����У�SO3 �İٷֺ�����ߵ��ǣ� ��
A��t2��t3 B��t0��t1 C��t5��t6 D��t3��t4
��ͼ����������Ϊt3ʱ�ı���������������__________��
��4��ͼ2��P�ǿ�����ƽ�л����Ļ���������ͬ�¶�ʱ����A�����г���4mol SO3��g�����ر�K����B�����г���2mol SO3��g�����������ֱ�����Ӧ����֪��ʼʱ����A��B�������ΪaL���Իش�
����Ӧ�ﵽƽ��ʱ����B������Ϊ1.2a L������B��SO3ת����Ϊ___________��
������K��һ��ʱ������´ﵽƽ�⣬����B�����Ϊ___________L����ͨ��������������Բ��ƣ��Ҳ������¶ȵ�Ӱ�죩��
���𰸡���1��0.04mol/(L��s) ��2���ڢ�
��3��B �������� ��4��40% 2.6a
��������
�����������1���跴Ӧ�Ķ�������Ϊx����
2SO2��g�� + O2��g��![]() 2SO3��g��
2SO3��g��
��ʼ��mol���� 2 2 0
��Ӧ��mol���� 2x x 2x
ƽ�⣨mol���� 2-2x 2-x 2x
20s���SO2������ٷֺ���Ϊ12.5%����ͬ�����£��������������������ʵ�������������2-2x��/ [2-2x + (2-x) + 2x]��100%=12.5%�����x=0.8����Ӧ���ĵĶ�����������ʵ���Ϊ��2��0.8mol=1.6mol����SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ��v��SO2��=(1.6mol/2L)/20s=0.04mol/��L/s����
��2�� ����Ӧǰ������������������ݻ������䣬����������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬���������������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ������������ƽ����Է��������������˵����Ӧ�ﵽƽ��״̬����ȷ���� v����SO2��=2v����O2������ʾ����Ӧ�������ʣ�����˵����Ӧ�ﵽƽ��״̬���������������Ũ�ȶ����ٷ����仯˵����Ӧ�ﵽƽ��״̬����ȷ����ѡ�ڢ���
��3������ͼ���֪��Ӧһֱ���淴Ӧ���������t3��t4ƽ�ⲻ�ƶ���˵���ı������Ӧ����ʹ���˴�����������SO3 �İٷֺ�����ߵ���t0��t1����ѡB��
��4������Ӧ�ﵽƽ��ʱ����B�����Ϊ1.2a L��BΪ��ѹ�����£��������ݻ�����������ʵ�������
�ȣ�˵���ﵽƽ��ʱ��������ʵ���Ϊ��Ӧǰ��1.2������ƽ��ʱ�����������ʵ���Ϊ2.4mol���跴Ӧ����������Ϊx����
2SO3��g��![]() 2SO2��g�� + O2��g��
2SO2��g�� + O2��g��
��ʼ��mol����2 0 0
��Ӧ��mol����x x 1/2x
ƽ�⣨mol����2-x x 1/2x
��2-x + x + 1/2x=2.4mol,x=0.8mol
���������ת����Ϊ��0.8mol/2mol��100%=40%��
������K��һ��ʱ������´ﵽƽ�⣬�ں��º�ѹ�����£�����B�н���6mol��������ﵽ��ƽ��Ϊ��Чƽ�⣬���Դﵽƽ��ʱ�����������ݻ�Ϊ��(6mol/2mol)��1.2aL=3.6aL����������B�����Ϊ��3.6aL-aL=2.6aL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���γɻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⣺
��1���л���M����̫������տ�ת����N��ת���������£�

��M��N��ȣ����ȶ����� ��
��2����֪CH3OH(l)��ȼ����Ϊ726.5kJ��mol��1��CH3OH(l) + 1/2O2(g) �T CO2(g) + 2H2(g) ��H=��a kJ��mol��1����a 726.5����������������������=������
��3��ʹCl2��H2O(g)ͨ�����ȵ�̿�㣬����HCl��CO2������1mol Cl2���뷴Ӧʱ�ͷų�145kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��4������͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ�4Al(s)+3TiO2(s)+3C(s)�T2Al2O3(s)+3TiC(s) ��H=��1176kJ��mol��1����Ӧ�����У�ÿת��1mol���ӷų�������Ϊ ��
��5����֪��Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H=+489.0 kJ��mol��1
CO(g)+1/2O2(g)=CO2(g) ��H=��283.0kJ��mol��1
C(ʯī)+O2(g)=CO2(g) ��H=��393.5kJ��mol��1
��4Fe(s)+3O2(g)=2Fe2O3(s) ��H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�230Th��232Th��˵����ȷ���ǣ� ��
A. 230Th��232Th�ĺ����������ͬ B. 230Th��232Th�Ļ�ѧ���ʲ�ͬ
C. 230Th��232Th��Ϊͬλ�� D. 230Th��232Th��ͬһ�ֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������п���˵����Ӧ 2HI(g)![]() H2(g)��I2(g)�Ѵ�ƽ��״̬����( )
H2(g)��I2(g)�Ѵ�ƽ��״̬����( )
�ٵ�λʱ�������� n mol H2 ��ͬʱ���� n mol HI
��һ�� H��H �����ѵ�ͬʱ������ H��I ������
�۰ٷ���� HI%��I2% �ܷ�Ӧ���� v(H2)��v(I2)��1/2v(HI)
��[HI]��[H2]��[I2]��2��1��1 ��v(HI)�ֽ⣽v(HI)���� ��ѹǿ����
A���٢ۢ� B���ڢ� C���ܢ� D���ܢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������⻯�����ȶ�����ǿ������˳����ȷ���ǣ� ��
A. CH4>NH3>H2O>HF B. SiH4>NH3>H2S>HCl
C. HF> H2O>NH3>PH3 D. NH3>PH3> H2S>HBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г�����һ�ּ�øϴ�·ۣ�������ϴ�·��м��������ļ��뵰��ø�Ƴɵġ�����ø�Ĵ����Ժ�ǿ������ĺ�����Ѫ���������ŷŵĵ����ʡ�����������������ˮ�����ȥ�����������У������ü�øϴ�·�ϴ�ӵ��ǣ� ��
����֯Ʒ ��ë֯Ʒ ������֯Ʒ ��˿֯Ʒ
A.�٢�
B.�ڢ�
C.�٢�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-����ɫ��+H2O![]() 2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����
2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����

A. ������Һ��ɫ���������Һ���
B. ����Cr2O72-��C2H5OH��ԭ
C. �ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D. ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������Ϊ16.8g�ı��汻������ͭ˿��������ȫ��û��ʢ��100gϡ������ձ��У�ǡ����ȫ��Ӧ��ͭ˿ȡ����������ʵ���е���ʧ�����ձ������ʵ�������Ϊ104g����ԭͭ˿�б��汻������ͭռԭͭ˿����������Ϊ��������
A��30% B��35% C��40% D��20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У����նԷ�Ӧ����û��Ӱ�����(����)
A. Ũ������ú��� B. ���������ķ�Ӧ
C. ���������ķ�Ӧ D. ������ķֽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com