
某温度下,在固定容积的密闭容器中,反应A(g)+3B(g) 2C
2C (g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
(g)达到平衡,测得平衡时A、B、C物质的量之比为1∶1∶2,若保持温度不变,以1∶1∶2的物质的量之比再充入A、B和C,下列判断正确的是( )
A.平衡不移动
B.平衡向逆反应方向移动
C.再次达到平衡时各物质的浓度都比原平衡时大
D.C的质量分数减小
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=127.4 kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=127.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2A(g)+B(g) C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)  2NO2(g) (Ⅱ)
2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下 列示意图正确且能说明反应达到平衡状态的是__________。
列示意图正确且能说明反应达到平衡状态的是__________。
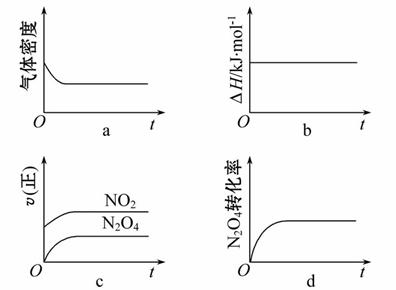
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ______mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液,又产生黄色沉淀。有关下列说法正确的是( )
A.产生的淡黄色沉淀为AgI
B.产生的黄色沉淀为AgBr
C.由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl)
D.上述实验现象说明沉淀之间可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH====KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为测定N aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1滴~2滴指示剂; ②向锥形瓶中加20 mL~30 mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.400 0 g~0.600 0 g邻苯二甲酸氢钾加入到250 mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是__________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?________________________________________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果__________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份质量均为0.510 5 g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00 mL,则NaOH溶液的物质的量浓度是多少?(结果保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com