
| A. | 2.7g | B. | 8.1g | C. | 5.4g | D. | 10.8g |
分析 铝的质量相同,硫酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=2:3,由方程式:2Al+3H2SO4═Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的Al反应时,消耗H2SO4较多,故酸与金属反应时酸不过量,碱与金属反应时碱足量,结合方程式计算解答.
解答 解:铝的质量相同,硫酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=2:3,由方程式:2Al+3H2SO4═Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的Al反应时,消耗H2SO4较多,故酸与金属反应时酸不过量,碱与金属反应时碱足量.
硫酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
3 3
0.3mol x
解得x=$\frac{0.3×3}{3}$=0.3mol,
则碱与金属铝反应生成的氢气的物质的量为0.3mol×$\frac{3}{2}$=0.45mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.45mol
解得y=$\frac{0.45mol×2}{3}$=0.3mol,
则铝的质量为0.3mol×27g/mol=8.1g,
故选B.
点评 本题考查化学反应方程式的计算,涉及过量计算问题,关键是判断反应中酸、碱是否足量,难度中等.


科目:高中化学 来源: 题型:选择题
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: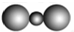 | B. | H2O2的电子式: | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
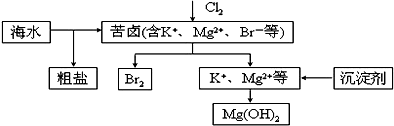 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
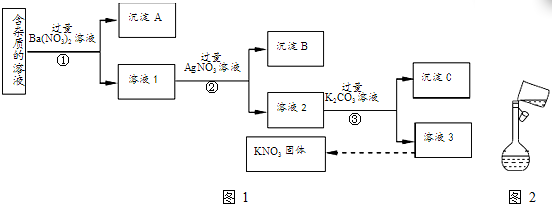
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
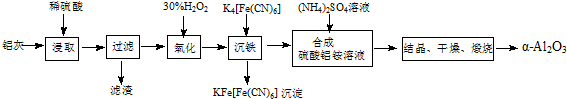
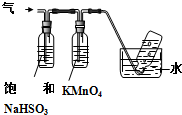
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com