
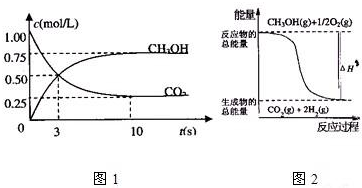
| 1 |
| 2 |
| △c |
| △t |
| △c |
| △t |
| (1-0.25)mol/L |
| 10s |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、用食醋除去暖瓶内的水垢 |
| B、用75%的乙醇溶液进行皮肤消毒 |
| C、碘单质遇淀粉变蓝 |
| D、鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
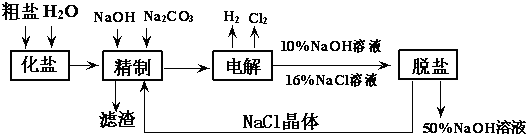
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.
实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com