
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为11的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
(1)第三周期ⅢA族 Mg>Al>N>O
(2)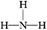 H∶
H∶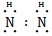 ∶H 离子键
∶H 离子键
(3)33 H3AsO4 NH3>PH3>AsH3
(4)2Fe3++Cu 2Fe2++Cu2+ KSCN溶液 溶液呈红色
2Fe2++Cu2+ KSCN溶液 溶液呈红色
(5)52 mol
【解析】蛋白质主要含有C、H、O、N等元素,由化合价可知X为N;Y为O、Z为Mg、W为Al、R为Fe;(2)氮原子最外层有5个电子,每个氢原子形成3个共价键,所以N2H4的结构式为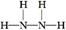 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。
,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。


科目:高中化学 来源:2014高考名师推荐化学化学平衡的标志(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学实验的基本操作(解析版) 题型:选择题
下列实验操作正确的是
①用50 mL量筒量取5.2 mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7 g氯化钠晶体;
④用碱式滴定管量取23.10 mL溴水;
⑤用瓷坩埚灼烧各种钠的化合物;
⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
⑦用浓盐酸清洗做过KMnO4分解实验的试管;
⑧将浓硝酸保存在无色试剂瓶中。
A.①②④ B.②③④⑤ C.③⑥⑦ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学反应中能量变化的有关概念及计算(解析版) 题型:选择题
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
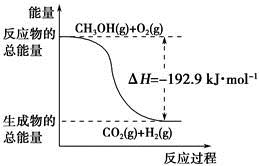
②CH3OH(g)+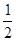 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物总能量
C.根据②推知反应:CH3OH(l)+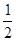 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如下图所示
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学制备实验方案的设计与评价(解析版) 题型:实验题
下列实验方案正确且能达到相应实验预期目的的是
|
|
|
|
A.制取少量蒸馏水 | B.制取少量NO2 | C.比较MnO2、Cl2、I2的氧化性 | D.探究NH4HCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数。下列叙述正确的是

A.最高价氧化物对应水化物的酸性:C>B
B.C单质是氧化性最强的非金属单质
C.A的氢化物中一定只含有极性键
D.B在第三周期ⅦA族
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
下列关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及其应用(解析版) 题型:选择题
下列说法正确的是
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是
A  B
B 
C  D
D 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com