
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为____________。
【答案】A AB CD 3S2O32— + 4Cr2O72— + 26H+ = 6SO42— + 8Cr3+ +13H2O
【解析】
某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4;
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,注意不能引入新的杂质;
(2)根据表中数据判断;通过钠离子交换树脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-,结合得失电子守恒和原子守恒写出离子方程式。
某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为Cr3+,再调节pH得到Cr(OH)(H2O)5SO4;
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-转移4.8mol e-,则1molCr2O72-转移6mol电子,所以生成Cr3+,S2O32-被氧化为SO42-,则反应的离子方程式为:3S2O32— + 4Cr2O72— + 26H+ = 6SO42— + 8Cr3+ +13H2O。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向浓度均为l×10-3mol/L的KCl和K2CrO4混合液中滴加l×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
C. 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将体积均为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V mL,pH随lg V的变化情况如图所示,下列叙述中正确的是
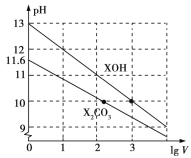
A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH>X2CO3
C. 已知H2CO3的电离平衡常数Ka1远大于Ka2,则Ka2约为1.0×1010.2
D. 当lg V=2时,若X2CO3溶液的温度升高,溶液碱性增强,则 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法不正确的是
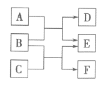
A. B晶体中阴、阳离子个数比为1:2
B. 等体积等浓度的F溶液与D溶液中,阴离子总的物质的量F>D
C. 0.1molB与足量A或C完全反应转移电子数均为0.1NA
D. Y、Z分别形成的简单氢化物的稳定性前者弱于后者,是因为后者分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
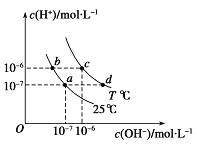
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是__________________________________(用文字和离子方程式说明)。
(3)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是
序号 | 反应物 | 产物 |
① | Cl2、H2O2 | Cl-、…… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | KClO3、HCl | Cl2、KCl、H2O |
A.第①组反应的氧化产物为O2
B.第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成3mol C12,转移6mol电子
D.氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②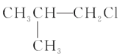 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com