
| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA |
分析 A、甲基不显电性;
B、乙烯所处的状态不明确;
C、乙烯和丙烯的最简式均为CH2;
D、C3H6可能为丙烯,也可能为环丙烷.
解答 解:A、9g甲基的物质的量为n=$\frac{9g}{15g/mol}$=0.6mol,而甲基不显电性,即1mol甲基中含9mol电子,则0.6mol甲基中含5.4NA个电子,故A错误;
B、乙烯所处的状态不明确,故其物质的量和含有的共价键个数无法计算,故B错误;
C、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含3NA个原子,故C正确;
D、C3H6可能为丙烯,也可能为环丙烷,故结构中不一定含碳碳双键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.
合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

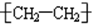
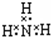
| A. | ⑧ | B. | 除⑥⑦外 | C. | 除③⑥⑦⑨外 | D. | ①④⑧⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-═O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
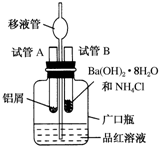 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com