
| A. | 配制100mL2mol/LNaCl溶液,将称量的NaCl放入烧杯中加20-30mL的蒸馏水搅拌溶解 | |
| B. | 蒸馏操作时,应将温度计插入烧瓶中的溶液中 | |
| C. | 测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 | |
| D. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
分析 A.配制一定物质的量浓度溶液时,先将药品放置在烧杯中溶解,冷却至室温后再转移到容量瓶中;
B.蒸馏时,温度计测量馏分温度;
C.测溶液pH时,应用玻璃棒蘸取或胶头滴管吸取滴在pH试纸上;
D.分液时,下层液体从下口倒出,上层液体从上口倒出.
解答 解:A.配制一定物质的量浓度溶液时,先将药品放置在烧杯中溶解,冷却至室温后再转移到容量瓶中,再加水至刻度线1-2cm处,用胶头滴管定容,故A正确;
B.蒸馏时,温度计测量馏分温度,所以温度计水银球位于蒸馏烧瓶支管口处,故B错误;
C.测溶液pH时,不能将pH试纸浸入待测溶液中,应用玻璃棒蘸取或胶头滴管吸取滴在pH试纸上,再跟标准比色卡比较,故C错误;
D.分液时,下层液体从下口倒出,为防止引进杂质,上层液体从上口倒出,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及pH测定、分液、蒸馏、溶液配制等知识点,侧重考查学生基本实验操作,明确实验原理及基本操作方法是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸 | B. | 通入CO2 | ||
| C. | 加热至固体质量不再减少为止 | D. | 加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
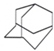 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
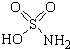 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )| A. | 不溶于水 | B. | 不能清洗铁锈 | ||
| C. | 水溶液中以分子形式大量存在 | D. | 与水反应生成的盐是NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com