
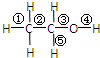
 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键. ;
; ;
; 2CH3CHO+2H2O;
2CH3CHO+2H2O;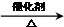 2CH3CHO+2H2O;④⑤;氧化反应
2CH3CHO+2H2O;④⑤;氧化反应| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
 CH3CH2Br+H2O;
CH3CH2Br+H2O;  CH3CH2Br+H2O; ③;取代反应
CH3CH2Br+H2O; ③;取代反应| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2-+2H2O?H2S+2OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、CO32-+H2O?HCO3-+OH- |
| D、HS-+H2O?H2S↑+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com