
我国成功发射“天宫一号”飞行器的长征Ⅱ火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水(H2O2).当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知此状况下:0.4mol液态肼与足量的液态双氧水反应放出256.0kJ的热量.(已知H2O(l)═H2O(g)△H=+44kJ•mol﹣1)
(1)则16g液态肼与液态双氧水反应在此状况下生成液态水时放出的热量是 kJ.
(2)(2)已知拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
考点: 有关反应热的计算.
专题: 化学反应中的能量变化.
分析: (1)根据热化学方程式的书写原则和注意问题写出热化学方程式和水转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答: 解:(1)已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量,1mol液态肼和足量双氧水反应生成氮气和水蒸气时放出
 =640.0KJ的热量;肼和双氧水反应的热化学方程式:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣640.0KJ/mol,
=640.0KJ的热量;肼和双氧水反应的热化学方程式:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣640.0KJ/mol,
②H2O(g)=H2O(l)△H=﹣44KJ/mol;
依据盖斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣816.0KJ/mol;
化学方程式中32g全部反应放热816.0KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.0KJ,
故答案为:40 8.0;
8.0;
(2)在反应N2+3H2⇌2NH3中,断裂3molH﹣H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N﹣H键,
放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ﹣2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ•mol﹣1.
点评: 本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,热化学方程式的计算,题目难度中等.注意把握从键能的角度计算反应热的方法.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
如表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
IA ⅡA ⅢA IVA VA ⅥA VⅡA 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
(1)10种元素中,化学性质最不活泼的是氩(填元素名称).
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是 (填化学式).
(3)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(4)⑧与⑨分别与H2形成的氢化物的稳定性:HCl HBr,(用化学式表示)最高价氧化物对应的水溶液的酸性 .(用化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)⇌2Z(g),一定达到化学平衡状态的是()
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol•L﹣1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是()
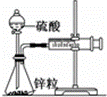
A. 用锌粒表示10 s内该反应的速率为0.013 g•s﹣1
B. 忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol•(L•s)﹣1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol•(L•s)﹣1
D. 用H2表示10 s内该反应的速率为0.004 mol•(L•s)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于平衡常数K的说法中,正确的是()
A. 在任何条件下,化学平衡常数是一个恒定值
B. 改变反应物浓度或生成物浓度都会改变平衡常数K
C. 平衡常数K只与温度有关,与反应浓度、压强无关
D. 从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应中的能量变化,表述正确的是()
A. 放热反应中,反应物的总能量大于生成物的总能量
B. 断开化学键的过程会放出能量
C. 加热才能发生的反应一定是吸热反应
D. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com