
【题目】工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________。
(2)若反应温度过高,反应速率下降(如图),其原因是______________。

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________。
(2)当电路中通过1![]() 电子的电量时,会有_________
电子的电量时,会有_________![]() 的O2生成。
的O2生成。
【答案】2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+ (或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+) 二氧化硫的还原性强于NO 生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行 ΔH3=2ΔH1+ΔH2 蛋白质变性(或硫杆菌失去活性) 2H2O+2e—=H2↑+2OH— 0.25
【解析】
Ⅰ.(1)NaClO2具有氧化性,可以将NO氧化为硝酸根或亚硝酸根,根据电荷守恒及原子守恒分析水参加反应,产物中有H+生成,则反应的离子方程式为2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+(或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+)。故答案为:2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+(或2H2O+ClO2-+4NO=4NO2-+Cl-+4H+);
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强于NO,故答案为:二氧化硫的还原性强于NO;
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是:生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,故答案为:生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行;
Ⅱ.(1)已知:①H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1,②4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2,
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2,
根据盖斯定律①×2+②得反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) ,则ΔH3=2ΔH1+ΔH2,故答案为:故ΔH3=2ΔH1+ΔH2;
(2)根据题给方程式知,硫杆菌在反应中作催化剂,温度过高时会失去活性,因此反应速率下降,故答案为:蛋白质变性(或硫杆菌失去活性);
Ⅲ.(1)阴极发生还原反应,根据放电顺序氢离子得电子生成氢气,反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(2)电解硫酸钠溶液相当于电解水,阳极发生氧化反应生成氧气,电极反应为:2H2O-4e-=4H++O2↑,则当电路中通过1![]() 电子的电量时,会有1
电子的电量时,会有1![]() ×
×![]() =0.25mol O2生成,故答案为:0.25。
=0.25mol O2生成,故答案为:0.25。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法错误的是
A.常温常压下,62 g P4中所含P—P键数目为2NA
B.23g钠在空气中反应生成Na2O和Na2O2,转移电子数为NA
C.标准状况下,11.2LCO2和SO2混合物中含O原子数目为NA
D.0.1mol氯化铁水解形成的Fe(OH)3胶体粒子数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
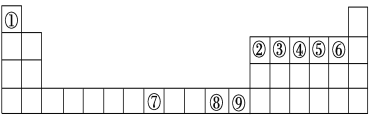
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛是制备乙酸、乙酸衍生物等化工产品的原料。完成下列填空:
(1)乙醛分子中的官能团为______。
(2)将铜丝在空气中灼烧变黑后,迅速伸入乙醇中,观察到铜丝表面______;反复上述多次操作后,闻到刺激性气味,说明有______生成。
(3)写出检验乙醛的化学反应方程式。______上述反应显示乙醛具有______性。
(4)已知甲酸也能发生银镜反应,若某甲酸溶液中可能混有乙醛,如何通过实验证明是否含有乙醛并写出简要操作步骤________________
(5)已知:有机化学中将紧邻官能团的第一个碳原子成为α—C,α—C上的H就称为α—H,醛的α—H较活泼,可以和另一个醛的羰基进行加成,生成羟基醛,如:
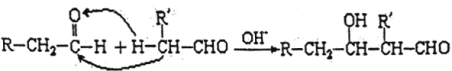
设计一条以乙烯为原料制备正丁醇CH3CH2CH2CH2OH的合成路线(无机试剂任选):_________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物K合成路线如下(图中表示链延长)
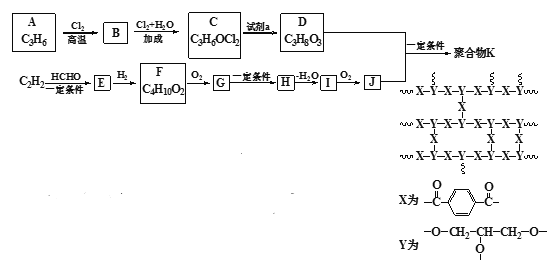
已知: ;
;

(1)按官能团分类,A的类别是__________。
(2)A→B的反应类型是________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)C2H2生成E的方程式是__________。
(6)G→H的方程式是__________。
(7)含有苯环,且与I互为同分异构体的酯有_____种。写出其中的一种结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Z、Y、P的原子序数逐渐增大。四种元素形成的化合物结构如图所示,其中各原子的核外电子排布均处于稳定结构。且X与Z、Y、P均可形成电子数相等的分子,X2P常温常压下为液体。下列说法不正确的是( )
![]()
A.X和P形成的化合物中可能存在非极性共价键
B.Z、Y、P的非金属性和最高价氧化物对应水化物的酸性都逐渐增强
C.Y的氢化物能和它的最高价氧化物对应水化物反应生成盐
D.X形成的简单离子半径不一定比Li+小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】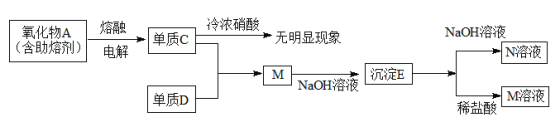
(1)M的化学式是AlCl3,用离子方程式表示其水溶液的酸碱性情况______________。
(2)元素C在周期表中的位置是第三周期第ⅢA族,其最高价氧化物对应的水化物的电离方程式是____________________。
(3)写出E与NaOH溶液反应的离子方程式________________________。
(4)单质C遇冷浓硝酸无明显现象的原因是______________________。
(5)电解熔融态氧化物A时,阳极发生的电极反应是___________________;没有发现熔剂之前,由于氧化物A熔点高,难以实现工业化过程,从物质结构角度说明A具有高熔点的原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com