
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
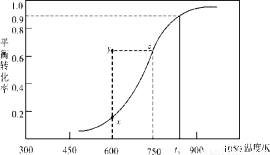
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
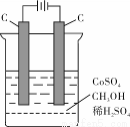
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。
科目:高中化学 来源:2015-2016学年河北省高二上学期12月月考化学试卷(解析版) 题型:选择题
某烯烃与H2加成后的产物是 , 则该烯烃的结构式可能有( )
, 则该烯烃的结构式可能有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县一中高一上学期第二次月考化学试卷(解析版) 题型:实验题
应用下列装置,在硬质破璃管中放入还原铁粉和石棉绒的混合物加热,并通过水蒸气,就可以完成“高温下Fe与水蒸气的反应实验”。
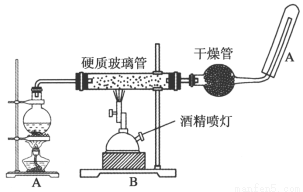
请完成该实验中的问题:
(1)写出该反应的化学方程式: ;该氧化还原反应的氧化剂是 。
(2)实验前必须对整套装置进行的操作是 。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)检验溶液中是否含有三价铁离子用 溶液(写化学式),现象是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+)/c(NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列对某些离子的检验及结论一定正确的是
A.先加入BaCl2溶液,产生白色沉淀,再加入HNO3溶液,白色沉淀不溶解,则溶液中一定含有大量的SO42﹣
B.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+
C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32﹣
D.加入氯化钠溶液,有白色沉淀产生,再加入稀硝酸沉淀不消失,一定有 Ag+
Ag+
查看答案和解析>>
科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
下列各组物质的分类正确的是
①同位素:1H、2H2、3H ②同素异形体:C80、金刚石、石墨
③酸性氧化物:CO2、NO、SO3 ④混合物:水玻璃、水银、水煤气
⑤电解质:明矾、冰醋酸、石膏 ⑥干冰、液氯、乙醇都是非电解质
A.②⑤ B.②⑤⑥ C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+ = 2Fe3+ + 3H2O
B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:
2H++ SO42-+Ba2++2OH—= BaSO4↓+2H2O
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.将1 mol/L NaAlO2溶液和1.5 mol/L的 HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
查看答案和解析>>
科目:高中化学 来源:2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷(解析版) 题型:填空题
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
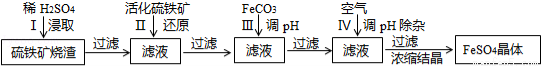
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号)。
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:填空题
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
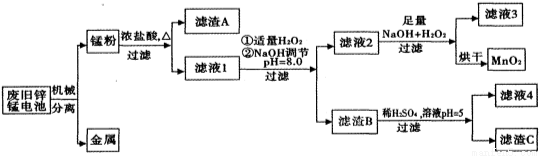
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com