
分析 根据已有的知识进行分析,M层就是原子的第三层电子数,L层就是原子的第二层电子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,故X原子第三层电子数为0,Y原子的第二层电子数为8,所以X原子的第二层有四个电子,是碳原子;Y原子的M层比X原子多三个电子,故第三层电子数为3,是铝元素,据此解答.
解答 解:M层就是原子的第三层电子数,L层就是原子的第二层电子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,故X原子第三层电子数为0,Y原子的第二层电子数为8,所以X原子的第二层有四个电子,是碳原子,碳是第二周期,第ⅣA族元素,
故答案为:第二周期,第ⅣA族.
点评 本题考查了常见元素的推断,完成此题,可以依据原子结构的有关知识进行.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCO2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
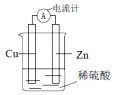
| A. | 该装置中能量转化方式为电能转化为化学能 | |
| B. | 电子从锌片流出,经导线流向铜片 | |
| C. | 工作一段时间之后,溶液颜色逐渐变蓝 | |
| D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
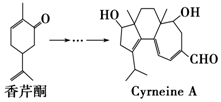 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从海带中提取单质碘及碘的化合物间的转化关系如图所示:
从海带中提取单质碘及碘的化合物间的转化关系如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com