
SO2是大气中常见的污染气体,溶于水后形成的溶液能导电,则SO2属于
A.强电解质 B.弱电解质 C.非电解质 D.不是电解质也不是非电解质
科目:高中化学 来源: 题型:
如图是立方烷的球棍模型,下列有关说法不正确的是
( )
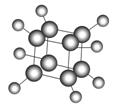
A.其一氯代物只有一种
B.其二氯代物有三种
C.在光照下,其能与氯水发生取代反应
D.它与苯乙烯(C6H5—CH===CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C2H4(g)和C2H5OH(1)的燃烧热分别是1411.0kJ·mol-1和1366.8kJ mol-1,则由C2H4(g)和H2O (l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
根据右图实验装置判断,下列说法正确的是
A.该装置能将电能转化为化学能
B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑
C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3


查看答案和解析>>
科目:高中化学 来源: 题型:
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)  2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
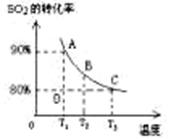 A.相同温度下新平衡时容器中的压强是原平衡时的两倍
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。
(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100mL 0.01 mol ·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2 的产量,可以使用如下方法中的
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1 mol ·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.⑤⑥⑧ D.③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
化学已渗透到人类生活的各个方面。下列说法不正确的是
A.凡含有食品添加剂的食物对人体健康均有害,不可食用
B.地沟油的主要成分是高级脂肪酸甘油酯,处理后可用于制肥皂
C.钻石、水晶、刚玉都是人们熟知的宝石,但其化学成分不同
D.低盐低脂饮食是目前大力提倡的健康饮食方法,可有效预防高血压等疾病
查看答案和解析>>
科目:高中化学 来源: 题型:
把3molA和2.5molB混合于2L密闭容器中,发生反应:
3A(g)+B(g) xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
(1) x= ;
(2) 平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com