
分析 (1)N2(g)+3H2(g)=2NH3(g)△H=-92.40kJ•mol-1 ①
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-86.98kJ•mol-1 ②
将①+②可得:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l),据盖斯定律来计算反应的焓变并书写热化学方程式;
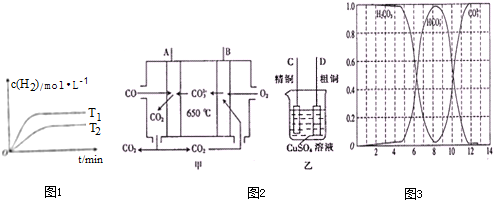
(2)①温度越高,反应速率快,得出T1>T2,根据图示:温度越高,氢气的浓度越大,根据温度对化学平衡移动的影响知识来回答判断;
②对于吸热反应,温度高,K越大;
(3)原电池负极发生氧化反应,正极发生还原反应,所以通入氧气的一极为正极,通入CO的一极为负极;B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
(4)根据二氧化碳和氢氧化钠反应原理结合图象可知,PH=10时,溶液中主要存在Na+、HCO3-、CO32-、H+、OH-,根据图象分析浓度大小.
解答 解:(1)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.40kJ•mol-1 ①
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-86.98kJ•mol-1 ②
将①+②可得:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=(-92.4KJ/mol)+(-86.98KJ/mol)=-179.38KJ/mol,
故答案为:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-179.38KJ/mol.
(2)①H2的平衡浓度与温度关系:温度越高,反应速率快,所以T1>T2,温度越高,氢气的浓度越大,所以反应式吸热的,即a>0,故答案为:>;>;
②对于吸热反应,温度高,K越大,T1>T2,所以T1时平衡常数K1>T2时平衡常数K2,故答案为:>;
(3)CO具有还原性,在负极上发生氧化反应生成CO2,所以A极的电极反应式为:CO-2e-+CO32-═2CO2,因A为负极,B为正极,粗铜精炼时,粗铜D作阳极,与电源的正极B相连,故答案为:CO-2e-+CO32-=2CO2;D;
(4)向0.1mol•L-1的氢氧化钠溶液中通入CO2,可发生:2NaOH+CO2═Na2CO3+H2O,NaOH+CO2═NaHCO3;pH=10时,溶液中主要存在Na+、HCO3-、CO32-、H+、OH-,由图象可以看出,c(HCO3-)>c(CO32-),因该溶液呈碱性,所以c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查反应热的计算、原电池和电解池原理、电离平衡及学生的识图和应用的能力,注意盖斯定律的理解与应用,明确图象中pH与离子的浓度关系是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②③ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
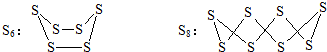
| A. | 硫单质S原子间都以σ键结合 | |
| B. | S6、S8分子中所有S原子都发生了sp3杂化 | |
| C. | S6和S8互为同位素 | |
| D. | 熔点的高低:S8>S6>S4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图.
A、B、C、D、E均是常见短周期元素,其在周期表中的位置如图. | A | |||||
| B | C | D | |||
| E | |||||
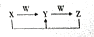 ,其中Y和Z在水溶液中存在的微粒种类相同.
,其中Y和Z在水溶液中存在的微粒种类相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量硫酸亚铁铵品体溶于水,先加入氯水,再滴入几滴硫氰化钾溶液,溶液变血红色,则可证明品体的成分中含有Fe2+ | |
| B. | 用到金属钠时,要用镊子取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| C. | 用pH计分别测定0.1mol•L-1的FeCl3和0.01mol•L-1FeCl3的pH,可以比较浓度对盐类水解程度的影响 | |
| D. | 通过测定等物质的量浓度的NaCl、Na2S溶液的pH,比较硫、氯两种元素的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com