
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
分析 根据溶液的浓度和化合物的组成判断两种溶液中离子浓度的关系,注意与溶液的体积无关,然后求出离子的物质的量,利用数目之比等于物质的量之比,由此分析解答.
解答 解:0.5L 1mol/L FeCl3溶液中c(Cl-)=3c(FeCl3)=3×1mol/L=3mol/L,n(Cl-)=0.5L×3mol/L=1.5mol;0.1L 1mol/L MgCl2溶液中c(Cl-)=2c(MgCl2)=2mol/L,n(Cl-)=0.L×2mol/L=0.2mol,所以数目之比等于1.5mol:0.2mol=15:2,
故选:C.
点评 本题考查的是物质的量浓度的相关计算,利用数目之比等于物质的量之比计算,题目难度不大,侧重于考查学生的分析能力和计算能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
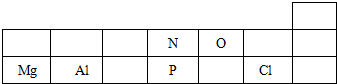
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
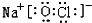 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体碳酸钠 | B. | 食醋 | C. | 白酒 | D. | 白糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com