
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
分析 (1)提高反应物的转化率,使得化学平衡正向进行的因素均可以(但是不能加入物质本身);
(2)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,结合化学平衡三段式列式计算C的浓度变化,计算得到反应速率v=$\frac{△c}{△t}$;
(3)根据三行式计算化学反应中物质的转化率以及物质的体积分数.
解答 解:(1)A(g)?2B(g)+C(g)+D(s),△H=+85.1kJ•mol-1,D为固体,反应前后气体体积增大的吸热反应,
A.升高温度,平衡正向移动,所以A的转化率增大,故A正确;
B.体系中通入A气体,相当于增大体系压强,平衡逆向进行A的转化率减小,故B错误;
C.通入稀有气体He,使体系压强增大到原来的5倍,总压增大分压不变,平衡不变,A的转化率不变,故C错误;
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水,氯化氢易溶于水导致C减少,平衡正向进行,A的转化率增大,故D正确;
故选AD;
故答案为:AD;
(2)A(g)?2B(g)+C(g)+D(s),平衡常数K=$\frac{{c}^{2}(B)×c(C)}{c(A)}$,设A消耗物质的量为x,
A(g)?2B(g)+C(g)+D(s),
起始量(mol) 0.10 0 0
变化量(mol) x 2x x
2小时量(mol)0.10-x 2x x
压强之比等于化学方程式计量数之比,$\frac{0.10-x+2x+x}{0.10}$=1.80
x=0.04mol
前2小时C的反应速率=$\frac{\frac{0.04mol}{1.0L}}{2h}$=0.02 mol/( L•h),
故答案为:$\frac{{c}^{2}(B)×c(C)}{c(A)}$; 0.02 mol/( L•h);
(3)容器内气体总压强(P)与起始压强P0的比值在20h后不变说明反应达到平衡状态,平衡时气体压强之比为
A(g)?2B(g)+C(g)+D(s),
起始量(mol) 0.10 0 0
变化量(mol) x 2x x
2小时量(mol)0.10-x 2x x
压强之比等于气体物质的量之比,
$\frac{0.10-x+2x+x}{0.10}$=2.4
x=0.07mol
平衡时A的转化率=$\frac{0.07mol}{0.1mol}$×100%=70%,
故答案为:70%.
点评 本题考查了化学反应速率、化学平衡的计算分析、化学平衡的影响因素判断,注意概念实质理解和平衡移动原理的应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
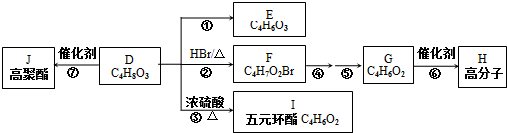
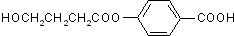 、I
、I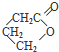 、J
、J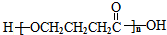 .
. .
. .
.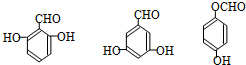 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
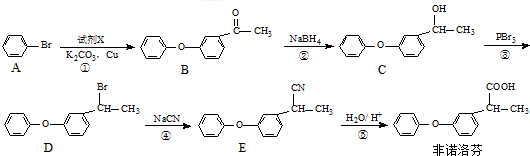
 .
. .
. .
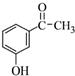
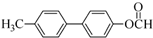
.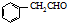 为原料制备
为原料制备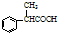 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  为证明非金属性强弱:S>C>Si | |
| B. | 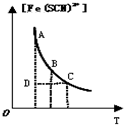 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)<V(逆) | |
| C. | 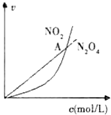 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 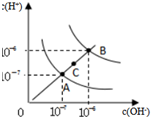 为水的电离平衡曲线图,若从A点到C点,可在水中加入适量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
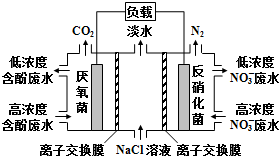
| A. | 右室电极为该电池的正极 | |
| B. | 左室电极反应式可表示为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| C. | 右室电极附近溶液的pH减小 | |
| D. | 工作时中间室的Cl-移向左室,Na+移向右室 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com