
【题目】实验室用63%的浓HNO3 (其密度为1.40 g·mL-1)配制200 mL 0.50 mol·L-1稀HNO3。
(1)此浓硝酸的物质的量浓度为________mol·L-1。(计算结果保留两位小数)
(2)应量取63%的浓硝酸____________mL,应选用________( A.10 mL量筒或B.50 mL量筒,填仪器的字母编号)。
(3)实验时还需选用的玻璃仪器有玻璃棒、烧杯、_______________(填仪器的名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)________。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】14.00 7.1 A 胶头滴管、250mL的容量瓶 ①③
【解析】
(1)利用c=![]() 进行计算;
进行计算;
(2)利用稀释定律推导出V浓=![]() ,计算浓硝酸的体积;
,计算浓硝酸的体积;
(3)配制溶液时的过程为:在烧杯中稀释浓硝酸,冷却后沿玻璃棒将溶液转移入容量瓶中,并用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切;
(4)①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶,取用的浓硝酸过多;
②容量瓶使用时未干燥,对反应结果无影响;
③定容时俯视,使读得的液体体积偏小;
④定容时不小心有少量蒸馏水滴到瓶外,对溶液体积无影响;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,加入溶剂过多。
(1)浓HNO3的浓度c=![]() =
=![]() =14.00mol/L,
=14.00mol/L,
(2)V浓=![]() =
=![]() =0.0071L=7.1mL;量取7.1mL的浓硝酸可选择10ml量筒;
=0.0071L=7.1mL;量取7.1mL的浓硝酸可选择10ml量筒;
(3)配制溶液时,在烧杯中稀释浓硝酸,冷却后沿玻璃棒将溶液转移入250mL容量瓶中,并用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切,实验时选用的玻璃仪器有玻璃棒、烧杯、胶头滴管和250mL容量瓶;
(4)①量取浓硝酸的量筒用蒸馏水洗涤,并把洗涤液转入容量瓶,取用的浓硝酸过多,导致浓度偏高;
②容量瓶使用时未干燥,对反应结果无影响;
③定容时俯视,使读得的液体体积偏小,导致从都偏高;
④定容时不小心有少量蒸馏水滴到瓶外,溶液体积没有影响,对浓度没有影响;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,加入溶剂过多,溶液浓度偏小;
浓度偏高的是①③。


科目:高中化学 来源: 题型:
【题目】实验室测定青蒿素(只含C、H、O元素)中氧元素质量分数的实验装置如图所示,下列实验操作或叙述正确的是

A.D装置的目的仅是氧化青蒿素分解的氢气,使之完全转化为水
B.E、F中分别加入的是碱石灰和P2O5
C.确定氧元素的质量分数,需要的数据是实验前后装置C、E、F的质量变化
D.该实验的不足之处仅仅是F之后没有接盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物的化学式可表示为xNa2SO4·yH2O2·zH2O, (其中x、y、z为各成分物质的量的最简整数比),其化学式可通过下列实验测定:
①准确称取 8.850g 样品,配制成 250mL 溶液A;
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液,反应至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体1.165g ;
③准确量取25.00mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1 KMnO4溶液与H2O2反应,消耗0.0010 mol KMnO4。 H2O2与KMnO4反应的方程式如下:
2KMnO4+5H2O2+3H2SO4 =2MnSO4+5O2↑+ K2SO4+8H2O
计算 8.850 g 样品中:
(1)Na2SO4的物质的量为___________________
(2)H2O2的物质的量为________________
(3)该硫酸钠-过氧化氢加合物的化学式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0molH2SO4。试计算:
(1)溶液中H2SO4的物质的量浓度。___________
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况下)。____________
(3)假设反应前后溶液体积不变,则所得溶液中FeSO4的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
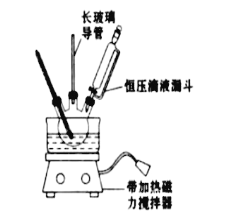
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:

可能用到的有关数据列表如下:

请回答下列问题:
(1)配制混酸应先在烧杯中加入_______.
(2)恒压滴液漏斗的优点是_______,实验装置中长玻璃导管可用____________代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为___________________________
(4)反应结束后产品在液体的_____层(填"上"或"下"),分离混酸和产品的操作方法为____________
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?___________
(6)试剂A是________,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为_______________若加热后,发现未加沸石,应采取的正确方法______________________________________
(7)硝基苯的产率为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
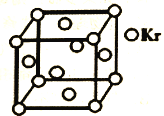
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)制取氢氧化铁胶体
①向煮沸的25mL蒸馏水中逐滴加入5~6滴_______溶液,继续煮沸至液体呈_____色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为_____________________.
②取少量Fe(OH)3胶体置于试管中,向试管中逐滴滴加稀盐酸,边滴边振荡.先出现红褐色沉淀,原因是胶体发生了_______,随后沉淀溶解,得到棕黄色溶液,写出该反应的化学反应方程式___________________________________________.
(2)如果FeCl3溶液中含有少量的NaCl,要除去NaCl得到纯净的FeCl3溶液,有下列方案:

试剂①是__________;试剂②是___________(均填化学式);
(3)已知:![]() 要从反应后的溶液中分离得到纯净的单质碘,需采取的操作有________、_________、_________(填操作名称)
要从反应后的溶液中分离得到纯净的单质碘,需采取的操作有________、_________、_________(填操作名称)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com