
【题目】清华大学王晓琳教授首创三室电解法制备LiOH,其工作原理如图所示,下列说法不正确的是( )

A.X电极连接电源正极
B.M为阴离子交换膜
C.Y电极反应式为![]()
D.制备2.4gLiOH产生的H2在标准状况下为1.12L
【答案】C
【解析】
该电解池实质是电解水,根据图知,Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,氢氧根浓度增大,故Y为电解池的阴极;X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,阳极反应式为2H2O-4e-=4H++O2↑。
A、根据以上分析,X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,应与电源正极相连,故A正确;
B、由图可知硫酸从最左侧导出,则SO42-需通过M进入最左侧,故M为阴离子交换膜,故B正确;
C、Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故C错误;
D、制备2.4gLiOH,n(OH-)=![]() =0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,标准状况下体积为0.05mol×22.4L/mol=1.12L,故D正确。
=0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,标准状况下体积为0.05mol×22.4L/mol=1.12L,故D正确。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.高锰酸钾溶液中,![]() 、
、![]() 、
、![]() 、葡萄糖分子能够大量共存
、葡萄糖分子能够大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() ,充分反应的离子方程式:
,充分反应的离子方程式:![]()
C.某温度下,![]() 的
的![]() 与
与![]() 混合溶液,一定存在
混合溶液,一定存在![]()
D.![]() ,已知
,已知![]() ,在
,在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.反应 ![]() ,增大压强该反应平衡常数增大
,增大压强该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D.改变条件,若反应物的转化率增大,平衡常数也一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下对于可逆反应![]() ,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
物质 | X | Y | Z |
初始浓度(mol·L-1) | c1 | c2 | c3 |
平衡浓度(mol·L-1) | 0.2 | 0.3 | 0.12 |
则下列判断正确的是( )
A.c1∶c2=2∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为2:3
D.c1的取值范围为0<c1<0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浸透了石蜡油的石棉放在试管中进行下列实验,请回答下列问题。
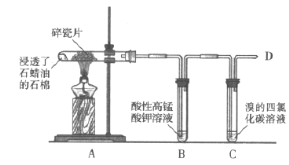
(1)反应一段时间后,B试管中的现象是___,由此说明石蜡油分解产生的气体具有___性(填“氧化”或“还原”)。
(2)若石蜡油分解产生乙烯,则C中发生反应的化学方程式是___。
(3)在D处点燃气体,观察到的现象是___。
(4)除去甲烷中混有的乙烯应采用的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1molL-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[p
变化关系如图所示[p![]() =-lg
=-lg![]() ]。下列说法正确的是( )
]。下列说法正确的是( )
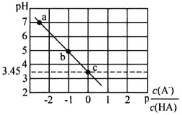
A.a点溶液中c(Na+)=c(A-)
B.电离常数K(HA)的数量级为10-4
C.滴加过程中![]() 不断减小
不断减小
D.b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com