
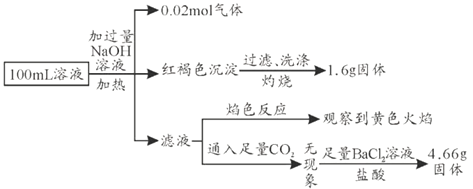
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
(![]() )
)
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
C.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
D.要确定原溶液中是否含有![]() ,其操作如下:取少量原溶液于试管中,滴加
,其操作如下:取少量原溶液于试管中,滴加![]() 溶液,紫红色不消失
溶液,紫红色不消失
【答案】C
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,过滤、洗涤、灼烧得到1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol含铁离子,可能为Fe3+、Fe2+,则原溶液中一定没有CO32-、HCO3-;滤液焰色反应为黄色,则溶液中一定存在钠离子,由于加入了NaOH,无法判断原溶液中是否含有Na+;通入足量的二氧化碳无现象,则原溶液中一定不存在A13+,在加足量的氯化钡溶液和盐酸,生成4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,一定不存在钡离子,据电荷守恒,原溶液中一定有Cl-,物质的量至少为0.02mol×2+0.02mol-0.02mol×2=0.02mol,以此解答该题。
A. 根据以上分析可以知道,原溶液中含有0.02mol含铁离子或亚铁离子,无法判断存在的是铁离子或者亚铁离子,故A错误;
B. 根据以上分析可以知道,原溶液中一定存在SO42-、NH4+、Cl-,一定不存在![]() 、
、![]() 、CO32-、Al3+;因为第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
、CO32-、Al3+;因为第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
C. 根据以上分析,原溶液中一定存在0.02mol NH4+,0.02mol SO42-,0.02mol Fe3+、Fe2+中的一种或两种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为:0.02mol×2=0.04mol,根据溶液电中性可以知道,原溶液中一定存在Cl-,且c(Cl-)≥(0.06mol-0.04mol)÷0.1L=0.2mol/L,故C正确;
D. 加入高锰酸钾,如含由亚铁离子,则被氧化生成铁离子,但高锰酸钾也能氧化氯离子,不能检验亚铁离子,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 和
和![]() 的混合气体中含电子总数为
的混合气体中含电子总数为![]()
B.![]() 氢化钾
氢化钾![]() 与足量水反应转移电子数为
与足量水反应转移电子数为![]()
C.92g甘油![]() 丙三醇
丙三醇![]() 中含C一H键总数为
中含C一H键总数为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 数之和为
数之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2HI(g)H2(g) +I2(g), 443℃时IL密闭容器中充入1 mol HI,体系中c(HI)与反应时间t的关系如图所示。下列说法正确的是
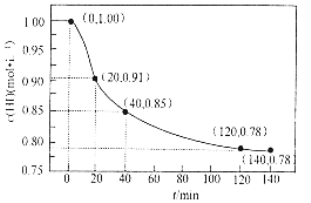
A.0~20 min内,v(H2) = 0.0045mol·L-1·min-1B.升高温度,HI会完全分解
C.40 min时,c(H2) = 0.075mol·L-1D.120 min反应达到最大限度,此时HI的转化率为78%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是研究物质的组成,结构,性质以及变化规律的一门以实验为基础的学科,在给定条件下,下列物质间转化均能实现的一组是( )
(1)![]()
(2)![]()
(3)![]()
(4)![]()
A.(1)(2)B.(2)(3)C.(2)(4)D.(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键,又有π键,并含有非极性键的是( )
①H2O2 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A. ②⑤⑥ B. ①②⑤⑥
C. ②④⑥ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有SO2和NOx(主要成分为NO和NO2的混合物),烟气的脱硫、脱硝技术是环境科学研究的热点。完成下列填空
(1)烟气脱硫、脱硝的环境意义是________________________________。
(2)液相氧化法采用碱性NaClO2溶液作为吸收剂,如脱除NO的原理为:____NaOH + ____NaClO2 + ____NO → ____NaNO3 + ____NaCl + ____H2O配平上述化学方程式。该反应中被还原的元素是_______________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的脱除效果。如脱除SO2的原理为:ClO- + SO2 + H2O=Cl-+ SO42- + 2H+。结合平衡移动原理分析使用Ca(ClO)2脱硫效果为何较NaClO更好?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X :______________ 沉淀A:______________ 沉淀B:________________。
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的物质的量是_____________。
(2)盐酸的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
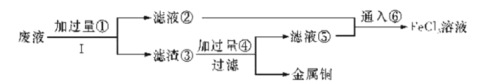
(1)写出下列物质的化学式①___、⑥___。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__色沉淀,此过程所涉及反应的化学方程式为:______、___。
(5)通入⑥发生反应的离子方程式:________。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___(填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com