
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是
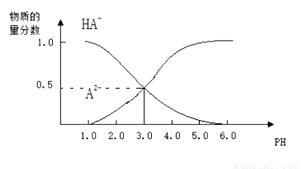
A.H2A的电离方程式为:H2A H++HA- ,HA-
H++HA- ,HA- H++A2-
H++A2-
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D.pH=4.0时,图中n(HA-)约为0.0091mol
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数,下列说法不正确的是( )
A、阿伏加德罗常数NA是0.012kg12 C中所含的原子 数
数
B、2g氢气所含氢原子数目为NA
C、标况下,22.4LNH3所含的分子数目为NA
D、1L 1 mo1·L-1NaCl溶液中所含有的Na+离子数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
19世纪中叶,门捷列夫的突出贡献是( )
A. 提出原子学说 B. 发现元素周期律 C. 提出分子学说 D. 发现氧气
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
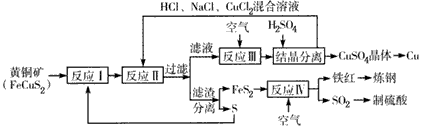
注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:选择题
下列有关有机物的说法正确的是
A.C8H10含苯环的烃同分异构体共有3种
B.丙烯酸(CH2COOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物
C.油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
D.青蒿素是抗疟疾特效药,其结构如图所示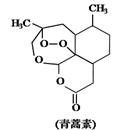 有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性
有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物、和水产资源等(如图所示),下列有关说法正确的是
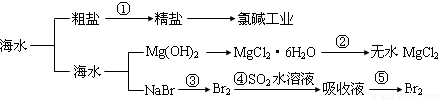
A.第①步中除去粗盐中的SO42- 、Ca2+ 、Mg2+ 、Fe3+ 等杂质,加入的药品顺序为:
Na2CO3 溶液→NaOH溶液→BaCl2 溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.从第③步到第⑤步的目的是为了浓缩
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A. Na、Al、Cl的原子半径依次减小,Na+、Al3+、C1-的离子半径也依次减小
B. 在第VIA族元素的氢化物(H2R)中,热稳定性最强的其沸点也最高
C. 第2周期元素的最高正化合价都等于其原子的最外层电子数
D. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下:
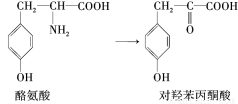
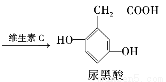
下列说法错误的是 ( )
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.对羟苯丙酮酸分子中有3种含氧官能团
C.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应
D.可用溴水鉴别对羟苯丙酮酸与尿黑酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com