
 某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )
某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )| A. | A为正极,B为负极 | |
| B. | 电解过程中,电解槽左侧溶液pH增大 | |
| C. | 电解过程中,Na+在电解槽中自左向右迁移 | |
| D. | 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7 |
分析 用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O),装置中右侧完成此反应需要产生氢离子,则右侧是溶液中氢氧根离子失电子发生氧化反应生成氧气,电极为阳极,左侧是氢离子得到电子生成氢气,电极为阴极,A为负极,B为正极,钠离子移向阴极,结合电子守恒计算.
解答 解:用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O),装置中右侧完成此反应需要产生氢离子,则右侧是溶液中氢氧根离子失电子发生氧化反应生成氧气,电极为阳极,左侧是氢离子得到电子生成氢气,电极为阴极,A为负极,B为正极,钠离子移向阴极,
A.分析可知A为负极,B为正极,故A错误;
B.电解过程中,电解槽左侧是氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,溶液pH增大,故B正确;
C.电解过程中,Na+在电解槽中自右向左迁移,故C错误;
D.当电路中通过lmol电子时,4OH--4e-=2H2O+O2↑,溶液中增加1mol氢离子,2CrO42-+2H+═Cr2O72-+H2O,阳极生成Na2Cr2O7 0.5mol,故D错误;
故选B.
点评 本题考查了电解原理的应用,主要是电极判断、电极反应、电极产物和溶液中PH变化,注意电解目的把Na2CrO4溶液转变为Na2Cr2O7溶液是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 45 mL | B. | 50 mL | C. | 30 mL | D. | 60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )| A. | n型半导体为负极 | |
| B. | X2为O2,H+由b极向a极移动 | |
| C. | b极的电极反应式为CO2+6e-+6H+=CH3OH+H2O | |
| D. | 当制备32g甲醇时,质子交换膜两侧溶液相差104g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
| A. | K3>K2=K1 | |
| B. | 实验Ⅱ可能使用了催化剂 | |
| C. | 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的$\frac{9}{10}$倍 | |
| D. | 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
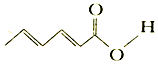
| A. | 分子式为C6H8O2 | |
| B. | 可使KMnO4(H+)溶液褪色 | |
| C. | 1 mol 该物质最多可与3 mol Br2 发生加成反应 | |
| D. | 可与醇发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加人少量固体NaOH,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “铁线粉”的主要成分为Fe2O3•xH2O | |
| B. | “用刀刮其销,…所刮下之销末”指质地酥松 | |
| C. | “铁线粉”易溶于水 | |
| D. | “铁线粉”的形成是因为吸氧腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com