
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.分析 (1)NaH是钠离子和氢阴离子构成的离子化合物,据此书写电子式,NaH与H2O反应是氢元素间发生的归中反应生成氢气;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+80.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g);
(3)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②依据化学平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%,计算此温度时的平衡常数,和在200℃时该反应的平衡常数K=64.8比较判断平衡进行的方向得到反应的能量变化;
(4)①化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=$\frac{52.29%}{40}$:$\frac{46.41%}{35.5}$:$\frac{1-52.29%-46.41%}{1}$=1:1:1,甲的化学式为CaHCl;
②化合物乙的水溶液显酸性,则为氯化氢,在高锰酸钾溶液中被氧化为氯气,高锰酸钾被还原为锰离子,结合电荷守恒、原子守恒配平书写离子方程式.
解答 解:(1)NaH是钠离子和氢阴离子构成的离子化合物,据此书写电子式为: ,NaH与H2O反应是氢元素间发生的归中反应生成氢气,反应的化学方程式为:NaH+H2O═NaOH+H2↑,
,NaH与H2O反应是氢元素间发生的归中反应生成氢气,反应的化学方程式为:NaH+H2O═NaOH+H2↑,
故答案为: ;NaH+H2O═NaOH+H2↑;
;NaH+H2O═NaOH+H2↑;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+80.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-1105kJ/mol,
故答案为:-1105kJ/mol;
(3)①CO2(g)+4H2(g)?CH4(g)+2H2O(g)
该反应的平衡常数表达式K=$\frac{c(C{H}_{4}){c}^{2}({H}_{2}O)}{c(C{O}_{2}){c}^{4}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{4}){c}^{2}({H}_{2}O)}{c(C{O}_{2}){c}^{4}({H}_{2})}$;
②向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的物质的量分别为CO2 0.4mol,H2 1.6mol,CH4 1.6mol,H2O 3.2mol.依据化学三行计算得到:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L)0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
则CO2的平衡转化率=$\frac{0.8mol/L}{1mol/L}$×100%=80%
在300℃时平衡常数K=$\frac{1.{6}^{2}×0.8}{0.2×0.{8}^{4}}$=25
若在200℃时该反应的平衡常数K=64.8>25,则升温平衡常数减小,说明平衡正反应为放热反应,则该反应的△H<0,
故答案为:80%,<;
(4)①化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=$\frac{52.29%}{40}$:$\frac{46.41%}{35.5}$:$\frac{1-52.29%-46.41%}{1}$=1:1:1,甲的化学式为CaHCl,化合物乙的水溶液显酸性,则为氯化氢,
故答案为:CaHCl;
②化合物乙的水溶液显酸性,则为氯化氢,与酸性高锰酸钾反应可得Cl2,反应的离子方程式为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2+8H2O,
故答案为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2+8H2O.
点评 本题考查了热化学方程式书写和盖斯定律计算应用、化学平衡常数计算、物质间的反应和性质、物质组成的计算判断等,明确物质的性质是解本题关键,性质决定用途,注意甲不仅含有氯元素、钙元素还有氢元素,为易错点,题目难度中等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| B. | 一定量的Fe与稀HNO3反应生成的盐中一定只有Fe(NO3)3 | |
| C. | 证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,然后加入氯水溶液变红色 | |
| D. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
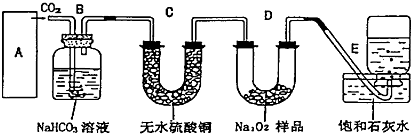

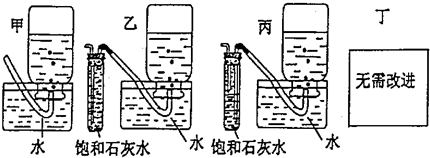
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com