
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
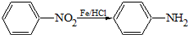 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.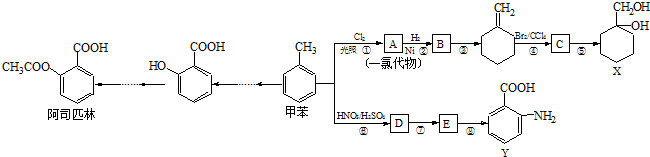
 ,C
,C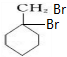 ,E
,E .
.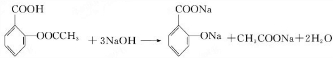 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式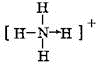 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
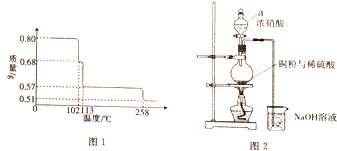 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态氧原子核外价电子的轨道表示式: | |
| B. | HClO的结构式为H-Cl-O | |
| C. | 用电子式表示NaCl的形成过程: | |
| D. | F-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com