
| ��� | ���������� | ���� |
| A | ��0.1 mol•L-1��ˮϡ�ͳ�0.01 mol•L-1����� pH��11.1��� 10.6 | ϡ�ͺ�NH3•H2O�ĵ���̶ȼ�С |
| B | �����£���ñ���Na2CO3��Һ��pH���� ����NaHCO3��Һ | ������ˮ��̶ȣ� CO32-��HCO3- |
| C | ��25 mL��ˮ�ͷ�ˮ�зֱ����5��FeCl3������Һ��ǰ��Ϊ��ɫ������Ϊ���ɫ | �¶����ߣ�Fe3+��ˮ��̶����� |
| D | ��������NaOH�Ҵ���Һ���Ȳ��������� ͨ��KMnO4������Һ�У���Һ��ɫ | ����������Ϊ��ϩ |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��ϡ�ʹٽ�������ʵĵ��룻
B������Na2CO3��Һ�뱥��NaHCO3��Һ��Ũ�Ȳ�ͬ��
C��ˮ��Ϊ���ȷ�Ӧ����ˮ��������ˮ��̶ȴ�
D����ȥ��Ӧ������ϩ�����Ҵ��ӷ�����ϩ���Ҵ����ܱ��������������
��� �⣺A����ϡ��pH�ı仯��֪һˮ�ϰ�Ϊ������ʣ�ϡ�ʹٽ�������ʵĵ��룬��ϡ�ͺ�NH3•H2O�ĵ���̶�����A����
B������Na2CO3��Һ�뱥��NaHCO3��Һ��Ũ�Ȳ�ͬ��Ӧ�ⶨ��Ũ����Һ��pH���Ƚ�ˮ��̶ȣ���B����
C��ˮ��Ϊ���ȷ�Ӧ��ǰ��Ϊ��ɫ������Ϊ���ɫ����֪��ˮ��������ˮ��̶ȴ����¶����ߣ�Fe3+��ˮ��̶�����C��ȷ��
D����ȥ��Ӧ������ϩ�����Ҵ��ӷ�����ϩ���Ҵ����ܱ������������������Һ��ɫ������˵����������Ϊ��ϩ����D����
��ѡC��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�漰���롢ˮ�⡢���ʼ��鼰�л������ʵȣ��������ʵ����ʼ���ѧ��Ӧԭ����ʵ�鼼�ܵĿ��飬ע��ʵ��������Է�������Ŀ�ѶȲ���


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��Ӧ�����������������������ڷ�Ӧ���ɵ�ˮ�������� | |
| B�� | 2 molˮ������������2 mol������1 mol������������ | |
| C�� | ����2 molH-H���Ͷ���1 molO�TO�����յ������������γ�4 molH-O���ų��������� | |
| D�� | ����4 molH-O�����յ������������γ�2 molH-H�����γ�1 molO�TO���ų��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a=1��b=4 | B�� | a=3��b=3 | C�� | a=2��b=3 | D�� | a=3��b=2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Զ��ױ� | B�� | ���� | C�� | �Ҵ� | D�� | ����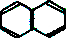 �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
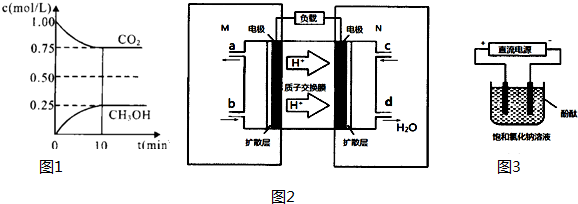
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 һ�ֹ⻯ѧ��صĽṹ��ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��AgCl��s��=AgCl��s��=Ag ��s��+Cl��AgCl����[Cl��AgCl����ʾ���ɵ���ԭ���������Ȼ�������]������Cl��AgCl��+e-��Cl-��aq����������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ���ǣ�������
һ�ֹ⻯ѧ��صĽṹ��ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��AgCl��s��=AgCl��s��=Ag ��s��+Cl��AgCl����[Cl��AgCl����ʾ���ɵ���ԭ���������Ȼ�������]������Cl��AgCl��+e-��Cl-��aq����������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ���ǣ�������| A�� | ����ʱ��������Y����X | |
| B�� | ����ʱ��Pt�缫�����ķ�ӦΪ2Cl-+2e-=Cl2 | |
| C�� | ����ʱ��Cl-��Ag�缫�ƶ� | |
| D�� | ����ʱ������ܷ�ӦΪ��AgCl��s��+Cu+��aq��$\frac{\underline{\;��\;}}{\;}$Ag ��s��+Cu2+��aq��+Cl-��aq�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HF��HCl��HBr��HI����������ǿ��˵��F��Cl��Br��I�ķǽ���������ǿ | |
| B�� | Ԫ��R�������Ϊ+7�ۣ�����RԪ��һ���Ǣ�A��Ԫ�� | |
| C�� | ��Ԫ�������ڱ��е�λ�ÿ����ƶϣ������������뵼����� | |
| D�� | ��M+��R2-������ͬ�ĵ��Ӳ�ṹ����ԭ�Ӱ뾶��M��R |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ʾ�ķ���ʽC6H14��������2-�����飮
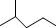
��ʾ�ķ���ʽC6H14��������2-�����飮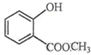 �к��еĹ����ŵ�����Ϊ�ǻ���������
�к��еĹ����ŵ�����Ϊ�ǻ����������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com