
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;
(3)将$\frac{②}{①}$得n,将n代入①中得k;
(4)①由图象可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),结合速率之比等于化学计量数之比计算;
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
结合平衡浓度计算该反应的平衡常数K;
(5)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当$\frac{n(NO)}{n(C{1}_{2})}$=1.5时产物的含量减大.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),则平衡常数K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$,
故答案为:K3=$\frac{{{K}^{2}}_{1}}{{K}_{2}}$;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,
故答案为:289-2a;
(3)$\frac{1.44×1{0}^{-7}}{3.6×1{0}^{-8}}$=$\frac{k(0.60)^{n}}{k(0.30)^{n}}$,n=2,将n代入①中得k=$\frac{3.6×1{0}^{-8}}{(0.30)^{2}}$mol-1•L•s-1=4.0×10-7 mol-1•L•s-1,
故答案为:2;4.0×10-7 mol-1•L•s-1;
(4)①根据图象可知T1<T2,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0,
故答案为:<;
②反应开始到10min时,c(C1NO)=1mol/L,则v(C1NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min),
则NO的平均反应速率v(NO)=v(C1NO)=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
③2NO(g)+Cl2(g)?2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K=$\frac{{1}^{2}}{{1}^{2}×0.5}$=2,
故答案为:2;
(5)$\frac{n(NO)}{n(C{1}_{2})}$的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当$\frac{n(NO)}{n(C{1}_{2})}$=1.5时产物的含量增大,所以应该是D点;
故答案为:A、D.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断及计算能力,利用三段式法进行有关计算,注意(4)中当n(NO)/n(Cl2)=2时反应物的转化率相等且产物的含量最大,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
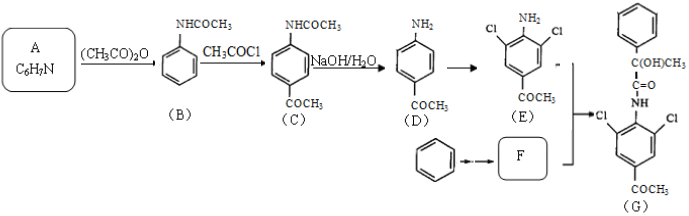 已知:
已知: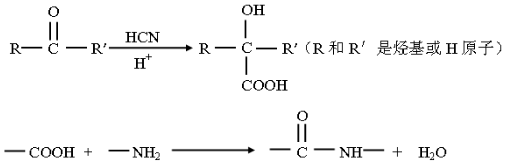
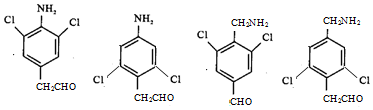
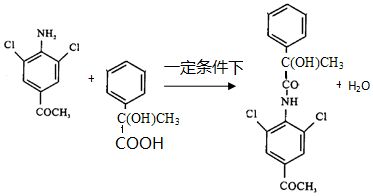
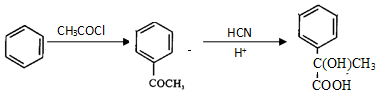 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
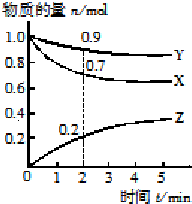 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁与稀硝酸完全反应,转移的电子数为0.2NA | |
| B. | 标准状况下,22.4L氢气和22.4L氦气所含的质子数均为0.2NA | |
| C. | 100mL2mol•L-1 碳酸钠溶液中,CO32-数为0.2NA | |
| D. | 标准状况下,22.4LSO3所含原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
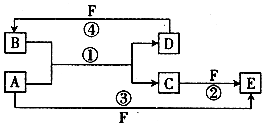 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com