
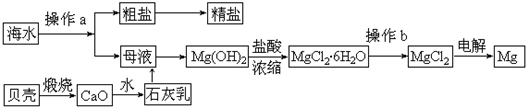
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
| 58g |
| 24g |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
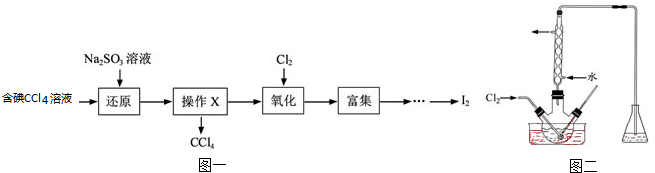
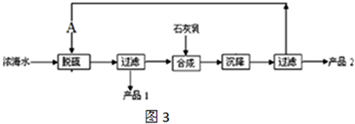
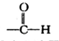 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位查看答案和解析>>
科目:高中化学 来源: 题型:
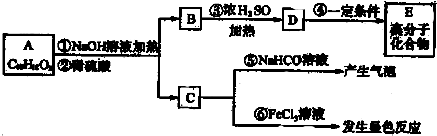
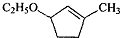
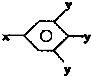 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
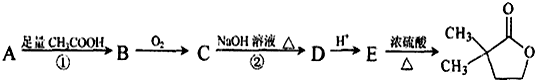
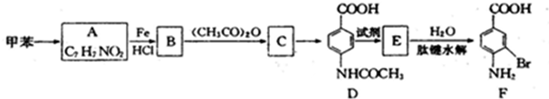
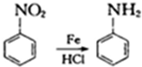
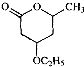 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从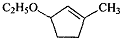 到
到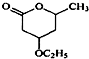 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).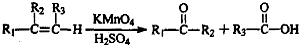 ;
;| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
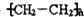 .
.
| H2O |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸溶液除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向FeBr2溶液中通入足量Cl2:Fe3++2Br-+Cl2═Fe3++Br2+2Cl- |
| C、向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3- |
| D、向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
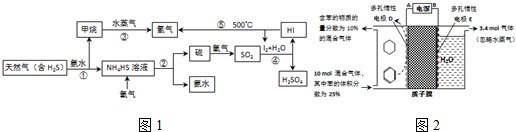
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com