
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
分析 n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,假设得到的固体是Na2CO3,m(Na2CO3)=106g/mol×0.05mol=5.3g,假设得到的固体是NaHCO3,m(NaHCO3)=0.05mol×84g/mol=4.2g,实际上得到的固体介于二者之间,所以得到的固体是Na2CO3和NaHCO3,
设Na2CO3和NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、固体质量列方程组为
$\left\{\begin{array}{l}{x+y=0.05}\\{106x+84y=5.08}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.04}\\{y=0.01}\end{array}\right.$,
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=2×0.04mol+0.01mol=0.09mol,
根据C=$\frac{n}{V}$计算氢氧化钠物质的量浓度.
解答 解:n(CO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,假设得到的固体是Na2CO3,m(Na2CO3)=106g/mol×0.05mol=5.3g,假设得到的固体是NaHCO3,m(NaHCO3)=0.05mol×84g/mol=4.2g,实际上得到的固体介于二者之间,所以得到的固体是Na2CO3和NaHCO3,
设Na2CO3和NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、固体质量列方程组为
$\left\{\begin{array}{l}{x+y=0.05}\\{106x+84y=5.08}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.04}\\{y=0.01}\end{array}\right.$,
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=2×0.04mol+0.01mol=0.09mol,
C(NaOH)=$\frac{n}{V}$=$\frac{0.09mol}{0.1L}$=0.9mol/L,故选D.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,正确判断固体成分是解本题关键,采用极限法、原子守恒来分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
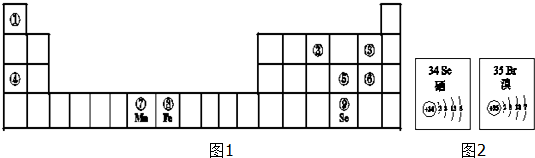
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
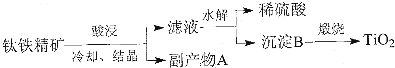
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学查阅资料后设计了一条1-丁醇的合成路线:
某同学查阅资料后设计了一条1-丁醇的合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com