
| A. | 恒温恒容容器中发生反应C(s)+H2O(g)?CO(g)+H2(g),当混合气体密度不变时反应达到平衡 | |
| B. | 平衡向右移动时,反应物的转化率一定增大,平衡常数不一定增大 | |
| C. | 恒温时向BaSO4悬浊液中加入Na2SO4固体,Ba2+浓度减小,溶度积KsP (BaSO4)不变 | |
| D. | 向氨水中逐滴加入盐酸,溶液呈中性时离子浓度为:c(Cl-)═c(NH4+)>c(H+)=c(OH-) |
分析 A.正反应方向是气体体积增大,气体质量减小的反应,结合密度ρ=$\frac{m}{V}$分析,正逆反应速率相同,各组分含量保持不变;
B.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
C.溶度积常数随温度变化,温度不变溶解沉淀平衡发生移动时溶度积常数不变;
D.中性溶液中存在电荷守恒.
解答 解:A.恒温恒容容器中发生反应C(s)+H2O(g)?CO(g)+H2(g),正反应方向是气体体积增大,气体质量减小的反应,当混合气体密度不变时反应达到平衡,故A正确;
B.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,平衡常数随温度变化,温度不变,平衡常数不变,故B错误;
C.恒温时向BaSO4悬浊液中加入Na2SO4固体,溶解后平衡逆向进行Ba2+浓度减小,但温度不变,所以溶度积KsP (BaSO4)不变,故C正确;
D.向氨水中逐滴加入盐酸,溶液中存在电荷守恒,c(Cl-)+c(OH-)═c(NH4+)+c(H+),溶液呈中性时,c(H+)=c(OH-),得到c(Cl-)═c(NH4+),离子浓度为:c(Cl-)═c(NH4+)>c(H+)=c(OH-),故D正确;
故选B.
点评 本题考查了化学平衡影响因素,溶度积常数、电解质溶液中电荷守恒,化学平衡常数是随温度变化的物理量,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 热的纯碱溶液去油污效果更好 | |
| C. | 包装用材料聚氯乙烯属于烯烃 | |
| D. | PX项目中的对二甲苯属于脂肪烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
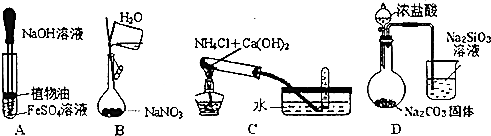
| A. | 观察Fe(OH)2的生成 | |
| B. | 配置1mol•L-1的NaNO3溶液 | |
| C. | 实验室制取氨气 | |
| D. | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛分子中最多有5个原子共平面 | B. | 苯酚分子中所有原子一定共面 | ||
| C. | 分子式为C2H6O的结构只有一种 | D. | 1,2-二溴乙稀不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W有4种不同结构(不考虑立体异构) | |
| B. | M分子中的3个C原子一定在同一平面上 | |
| C. | M、N、W均可发生氧化反应、还原反应和取代反应 | |
| D. | 若N中的O原子为18O,则上述反应充分进行后,所得混合物中N和W均含有18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度130℃、压强3.03×105Pa | B. | 温度25℃、压强1.01×105Pa | ||
| C. | 温度130℃、压强5.05×105Pa | D. | 温度0℃、压强5.05×105Pa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
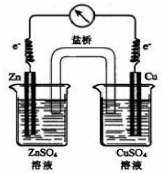
| A. | 该装置可以将化学能转变为电能 | B. | 电子由锌电极向铜电极移动 | ||
| C. | 盐桥中的阴离子向锌电极移动 | D. | 锌电极为正极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| D. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com