

分析 I.(1)仪器连接顺序:Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置;实验前要检验装置的气密性;
(2)硬质试管中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁;
(3)反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,正极上ClO-得电子生成Cl-;
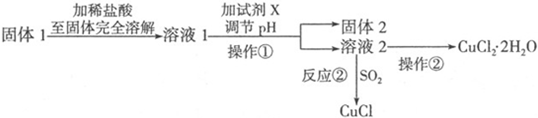
Ⅱ.粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体2为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl2•2H2O;
(1)溶液2中若含有杂质离子则是Fe3+,用KSCN溶液检验;
(2)配制CuCl2溶液,要防止铜离子的水解,需要加入适量稀盐酸;
(3)用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的物质;
(4)根据信息可知:SO2与铜离子反应生成CuCl白色沉淀和SO42-.
解答 解:I.(1)仪器连接顺序:Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置,所以各仪器接口顺序是:a→d、e→j、h→f、g→b;该实验中有有毒气体参加反应,所以实验前要检验装置的气密性;
故答案为:d、e,j、h,f、g,b;
(2)硬质试管中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁,反应方程式分别为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(3)反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,该溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,ClO-得电子作正极生成Cl-,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
Ⅱ.(1)由流程图分析可知溶液2中若含有杂质离子则是Fe3+,用KSCN溶液检验Fe3+,若有Fe3+,溶液变红;
故答案为:KSCN溶液;
(2)在配制CuCl2溶液,要防止铜离子的水解,需要加入适量稀盐酸,配制方法为:将称量的晶体置于烧杯中,加入适量的稀盐酸和蒸馏水,用玻璃棒搅拌;
故答案为:将称量的晶体置于烧杯中,加入适量的稀盐酸和蒸馏水,用玻璃棒搅拌;
(3)用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3;
故答案为:c、e;
(4)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
点评 本题考查物质的制备实验方案、化学工艺流程,考查了装置及操作的分析评价、离子检验、电极反应、离子方程式的书写等,侧重于基础知识的综合应用,难度中等.


科目:高中化学 来源: 题型:填空题
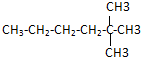 用“键线式”可表示为
用“键线式”可表示为 ,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为
,其中每个端点和转折点都表示一个碳原子,氢原子已省略.某有机物分子用键线式表示为 ,该有机物的分子式为:C10H20,其一氯代物有4种.
,该有机物的分子式为:C10H20,其一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1,
,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1, 键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.
键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片投入到稀硫酸中 | B. | H2与O2点燃生成H2O | ||
| C. | 向澄清的石灰水中加入Na2CO3溶液 | D. | 向稀盐酸中滴加KOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com