
���� ��1����H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-285.8 kJ/mol��
��C2H4��g��+3O2��g��=2H2O��l��+2CO2��g����H=-1411.0kJ/mol��
��H2O��g���TH2O��l����H=-44kJ/mol
������ʽ6��-��-4�۵�6H2��g��+2CO2��g��$\frac{\underline{\;����\;}}{\;}$C2H4 ��g��+4H2O��g����H������Ӧ�ĸı䣻
��2������ƽ�ⳣ�����¶ȱ仯�����¶ȶ�ƽ���ƶ���Ӱ�죬��Ӧ�Է����е��ж������ǡ�H-T��S��0���ݴ��жϣ�
��3��A����Ӧ�Ƿ��ȷ�Ӧ���¶�����ƽ��������У�
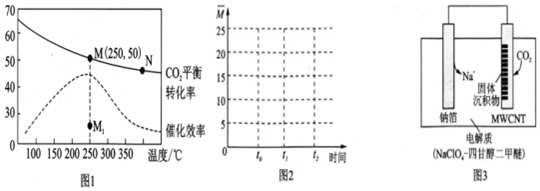
B������ͼ�������
C��ͼ��M��ʱ������̼��ת����50%����ϻ�ѧƽ�����м�����ʽ�õ���
D�����������������䣬������䣬���Ի��������ܶ�ʼ�ղ��䣻
��4����Ӧǰ��������ƽ����Է�������=$\frac{44��2+2��6}{2+6}$=12.5�����ŷ�Ӧ���У���������ʵ�����С����������ƽ����Է�������������t0ʱ�ﵽ��ѧƽ�⣬t1ʱ���������˲��������2V L��ƽ�����淽���ƶ���t2ʱ���´�ƽ�⣻
��5���������õ��ӷ�����ԭ��Ӧ��д�缫����ʽ��
��6���ݵ缫����ʽ�õ������������������������
��7��ѡ���{������-�ĸʴ������������Һ���ŵ��ǵ����Ժã�������Ʋ���Ӧ���ѻӷ����ݴ˽��з�����
��� �⣺��1����H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-285.8 kJ/mol��
��C2H4��g��+3O2��g��=2H2O��l��+2CO2��g����H=-1411.0kJ/mol��
��H2O��g���TH2O��l����H=-44kJ/mol
������ʽ6��-��-4�۵�6H2��g��+2CO2��g��$\frac{\underline{\;����\;}}{\;}$C2H4 ��g��+4H2O��g����H=6��-285.8 kJ/mol ��-��-1411.0kJ/mol ��-4��-44kJ/mol��=-127.8kJ/mol��
�ʴ�Ϊ��-127.8��
��2�����������Ȼ�ѧ����ʽ����H��0��������ȷ�Ӧ��6H2��g��+2CO2��g��$\frac{\underline{\;����\;}}{\;}$C2H4 ��g��+4H2O��g����Ӧǰ�����������С���ر��S��0�������H-T��S��0��Ӧ�ڵ��������Է����У������Ǹ��ݡ�G=��H-T��S����H��0��S��0��Ҫʹ��Ӧ�Է�����ʹ��G��0��������½��У�
�ʴ�Ϊ�����£����ݡ�G=��H-T��S����H��0��S��0��Ҫʹ��Ӧ�Է�����ʹ��G��0��������½��У�
��3��A�������¶ȶ�����̼��ƽ��ת���ʼ��ͣ�������ƽ�������ƶ�������M��ѧƽ�ⳣ������N����A��ȷ��
B����ͼ���֪�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ�ڵ�M����B����
C�������ܱ������г��������Ϊ 3��1�� H2 ��CO2����Ϊ3mol��1mol����ͼ��M��ʱ������̼ת����50%��
6H2��g��+2CO2��g��$\frac{\underline{\;����\;}}{\;}$C2H4 ��g��+4H2O��g��
��ʼ����mol�� 3 1 0 0
�仯����mol�� 1.5 0.5 0.25 1
ƽ������mol�� 1.5 0.5 0.25 1
����CH2=CH2���������=$\frac{0.25}{1.5+0.5+0.25+1}$��100%=7.7%����ͼ1��M��ʱ����ϩ���������Ϊ7.7%����C��ȷ��
D�����������������䣬������䣬���Ի��������ܶ�ʼ�ղ��䣬���Բ��ܸ��ݻ��������ܶ����жϻ�ѧ��Ӧ�Ƿ�ﵽƽ��״̬����D����
�ʴ�Ϊ��AC��
��4����Ӧǰ��������ƽ����Է�������=$\frac{44��2+2��6}{2+6}$=12.5�������������Ϊ��0��12.5�������ŷ�Ӧ���У���������ʵ�����С����������ƽ����Է�������������t0ʱ�ﵽ��ѧƽ�⣬��ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=$\frac{28+18��4}{1+4}$=20����t0��ƽ��ʱ$\overline{M}$Ӧ�����䣨12.5��20����t1ʱ���������˲��������2V L��ƽ�����淽���ƶ���t2ʱ���´�ƽ�⣬ƽ����Է���������С��t2��ƽ��ʱ $\overline{M}$Ӧ����12.5������ͼ��Ϊ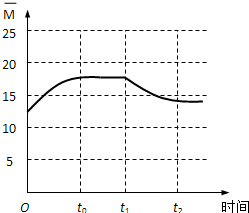 ��
��
�ʴ�Ϊ�� ��
��
��5������CO2�õ��ӷ�����ԭ��Ӧ���ʵ缫����ʽΪ3CO2+4Na++4e-=2Na2CO3+C��
�ʴ�Ϊ��3CO2+4Na++4e-=2Na2CO3+C��
��6�����������ĵ缫��Ӧ
3CO2+4Na++4e-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05��
m���ܣ�=m��Na2CO3��+m��C��=106g/mol��0.1mol+12g/mol��0.05mol=11.2g��
���������ĵ缫��Ӧ
4Na-4e-=4Na+
92 4
4.6 0.2��m��Na��=4.6g��
��������������Ϊ11.2g+4.6g=15.8g��
�ʴ�Ϊ��15.8��
��7��ѡ���{������-�ĸʴ������������Һ���ŵ��ǵ����Ժã�������Ʋ���Ӧ���ѻӷ���
�ʴ�Ϊ�������Ժã�������Ʋ���Ӧ���ѻӷ���
���� ���⿼�鱾�⿼���˸�˹���ɡ���ѧƽ���ƶ���Ӱ�����ء���ѧƽ�����ȣ�ע����ո�˹���ɵ�Ӧ�÷���������ʽ�ڻ�ѧƽ������е����Ӧ���ǽ���Ĺؼ��������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ�����������������ͻ�ͼ��������Ŀ�ѵ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
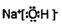 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O2�ĵ���ʽ��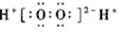 | B�� | CCl4�ĵ���ʽ��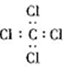 | ||
| C�� | ${\;}_{\;}^{18}$O��ԭ�ӽṹʾ��ͼ��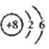 | D�� | MgCl2�ĵ���ʽ��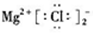 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
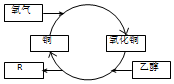
| A�� | R�Ļ�ѧʽΪC2H4O | |
| B�� | �Ҵ������˻�ԭ��Ӧ | |
| C�� | ��Ӧ�����й����к�ڽ���仯������ | |
| D�� | �Ҷ�����HO-CH2-CH2-OH��Ҳ�ܷ������Ʒ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���÷��ܡ�̫���ܵ������Դ���滯ʯȼ�ϣ��ɼ��ٻ�����Ⱦ | |
| B�� | ú�ĸ���ú��������ú��Һ�������ڻ�ѧ�仯 | |
| C�� | ����ˮ����������ˮ����Fe2��SO4��3��ClO2����������ˮ����ԭ����ͬ | |
| D�� | ��ˮ�е���բ�����ӵ�Դ�ĸ���������������ӵ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�� | ���� | ���� |
| A | ��pH��ֽ��⣺0.1mol•L-1Na2SO3��Һ��0.1mol•L-1NaHSO3��Һ | Na2SO3��Һ��pHԼΪ10�� NaHSO3��Һ��pHԼΪ5 | HSO3-���H+��������SO32-ǿ |
| B | ���з�̪��Na2CO3��Һ�м�������BaCl2���� | ��Һ��ɫ��dz | Na2CO3��Һ�д���ˮ��ƽ�� |
| C | ע����������NO2�����������ע�������ѹ��Ϊԭ����һ�� | ������ɫ����ʼʱdz | ��ѹ��NO2ת��Ϊ��ɫ��N2O4 |
| D | ����BaSO4����Һ�м��뱥��Na2CO3��Һ����Ȼ����ˡ�ϴ�ӣ������ù����м������� | ���������ܽ������������ | Ksp��BaSO4���� Ksp��BaCO3�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ��Ŀ�� | ��ѡ��Ҫ����������̨�Ⱥ��ԣ� | ���ֲ��� |
| A | ��Ũ��������480mL0.1mol/L������Һ | 500mL����ƿ���ձ�������������Ͳ����ͷ�ι� | ����ȡ�õ�Ũ�����������ƿ�У���ˮ�ܽ����̶��� |
| B | ��ʳ��ˮ�еõ�NaCl���� | �������ƾ��ơ��������������ǡ����ż� | �������������������ʱ��ֹͣ���ȣ��������ȼ��� |
| C | ����״����͵Ļ���� | ������ƿ���ƾ��ơ��¶ȼơ�ֱ�������ܡ���ƿ��ţ�ǹ� | �¶ȼ�ˮ�������ҺҺ������ |
| D | ��CCl4��ȡ��ˮ�е�Br2 | ��Һ©�����ձ� | ����ʱ�²�Һ��ӷ�Һ©���¿ڷų����ϲ�Һ����Ͽڵ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Fe3+ | Ni2+ | Cr3+ | |
| ��ʼ���� | 1.5 | 6.7 | 4.0 |
| ������ȫ | 3.4 | 9.5 | 6.9 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com