
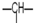
 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属中密度最小,熔、沸点最高的是铯 | |
| B. | 钠离子核外电子数比钠原子核外电子数少 | |
| C. | 碱金属单质都可保存在煤油中 | |
| D. | 金属钠着火时,可用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在热化学方程式中无论是反应物还是生成物必须表明聚集状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com