
将5g某金属加入100mL4mol/L的稀硫酸中,当硫酸的浓度降到原浓度的一半时(设溶液的体积不变),金属还没有全部溶解,该金属可能是
[ ]
科目:高中化学 来源: 题型:阅读理解
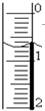 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值。高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料。
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解。
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许。
Ⅳ.调节pH至8~10, 加热至60~70℃, ,搅拌1h,过滤,除去残渣。
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为x g/L。
请回答:
(1)用电子式表示HCl的形成过程 。
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是 (填序号)。
① 原子半径 ② 最外层电子数
③ 金属性 ④ 最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式: 。
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理 。
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式: 。
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为 。
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818g,溶剂为1000 g,经测定该溶液的密度为1.5g/mL,则该溶液溶质的质量浓度x为 g/L(计算结果保留整数) 。
查看答案和解析>>
科目:高中化学 来源:丰台区一模 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2011年北京市丰台区高考化学一模试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com