
| A. | 该电池不宜在高温下工作 | |
| B. | 若该电池为酸性介质,正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 放电过程中,电池内阳离子向正极迁移 | |
| D. | 若该电池为碱性介质,以葡萄糖为原料并完全氧化,负极反应式为:C6H12O6-24e-+6H2O═6CO2↑+24H+ |
分析 A、根据酶在高温下容易发生变性判断;
B、该电池为酸性介质,正极为氧气得电子结合氢离子生成水;
C、根据放电过程中,电池内阳离子移向正极,阴离子移向负极判断;
D、以葡萄糖为原料并完全氧化,则电池中葡萄糖失电子,在负极反应,据此书写.
解答 解:A、因为酶在高温下容易发生变性,所以该电池不宜在高温下工作,故A正确;
B、该电池为酸性介质,正极为氧气得电子结合氢离子生成水,反应为O2+4e-+4H+═2H2O,故B正确;
C、根据放电过程中,电池内阳离子移向正极,阴离子移向负极,故C正确;
D、以葡萄糖为原料并完全氧化,则电池中葡萄糖失电子,在负极反应,又该电池为碱性介质,所以生成的二氧化碳和氢离子继续与碱反应生成碳酸根和水,故D错误;
故选D.
点评 本题考查了新型燃料电池,侧重于原电池原理的应用的考查,题目难度不大,注意电极方程式的书写与电解质溶液的酸碱性之间的关系及离子移动方向.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 解释或结论 |
| 在稀硝酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| AgI沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,任何电解质的稀溶液中,pC(H+)+pC(OH-)=14 | |
| B. | 0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 | |
| C. | 0.01mol/L的BaCl2 溶液中,pC(Cl-)=2pC(Ba2+) | |
| D. | 用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
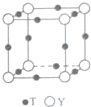 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KOH | C. | Al2O3 | D. | MgSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com