


科目:高中化学 来源: 题型:
| A、在 IA族元素中寻找新型耐高温耐腐蚀的材料 |
| B、半导体材料在金属元素和非金属元素分界线附近 |
| C、在过渡元素中可以寻找新型催化剂材料 |
| D、通常农药中所含的元素位于周期表右上角 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
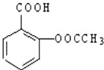 ,难溶于水.为了使疗效更好,它可与
,难溶于水.为了使疗效更好,它可与查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的②和③在人体内充分消化吸收时,③释放的能量更大 |
| B、①能使④失去生理活性而变性 |
| C、①可由②水解的最终产物反应制得 |
| D、③和石油的裂解都是高分子生成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com