
 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
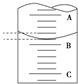 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
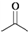 ,则
,则 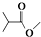 分子式:C5H8O2.
分子式:C5H8O2. .
. .
.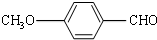 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、
、 ;
; ,
, (任意两种)(任写其中二种).
(任意两种)(任写其中二种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 2p轨道上只有一个成单电子的X原子与3p轨道上只有一个成单电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有1个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
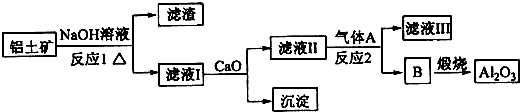
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com