
1—20号中的某几种元素微粒的电子层结构均为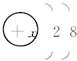 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号:
(1)A微粒一般不与其他物质发生反应,则A为_____________________________。
(2)B微粒所在的元素是地壳中含量最多的,则B为__________________________。
(3)C微粒氧化性很弱,但获得一个电子后形成的电中性的原子则还原性很强,则C为_____。
(4)D微粒与H+相结合形成的化合物,能腐蚀玻璃,则D为____________________。
科目:高中化学 来源: 题型:
 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号:(1)A微粒一般不与其他物质发生反应,则A为_____________________________。
(2)B微粒所在的元素是地壳中含量最多的,则B为__________________________。
(3)C微粒氧化性很弱,但获得一个电子后形成的电中性的原子则还原性很强,则C为_____。
(4)D微粒与H+相结合形成的化合物,能腐蚀玻璃,则D为____________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)查看答案和解析>>
科目:高中化学 来源:2015届重庆市三峡名校联盟高一下学期期中考试化学试卷(解析版) 题型:填空题
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
元素代号 A B C D E
原子半径/nm 0.075 0.143 0.102 0.099 0.074
主要化合价 +5,—3 +3 +6,—2 —1 —2
F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。
请回答下列问题:
(1)B的原子结构示意图为 。
(2)F2C和F2E两种化合物中,沸点较高的是 (填化学式),原因是 。
(3)用电子式表示化合物AF3的形成过程 。
(4)G的单质能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为 。
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式
。
(6)在2L密闭容器中,一定温度下,能说明反应2AE(g)+E2(g) 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)
a. 2V逆(AE)=V正(E2)
b.容器内压强保持不变
c. 容器内密度保持不变
d. 各组分的物质的量浓度相等
e. 混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。 则该电池的负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com