
| A. | 煤燃烧时将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅烷的分子通式可表示为SinH2n+2 | B. | 甲硅烷燃烧生成SiO2和H2O | ||
| C. | 甲硅烷的沸点高于甲烷 | D. | 甲硅烷的稳定性比甲烷强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LSO3含有的分子数等于0.1NA | |
| B. | 1 mol Na2O2所含阴离子数为2NA | |
| C. | 常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA | |
| D. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑. .
. HN3+OH-;.
HN3+OH-;.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
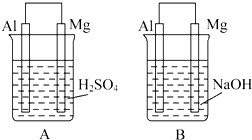 有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )
如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )| A. | A-Cu B-Zn C-CuSO4 | B. | A-Ag B-Fe C-HCl | ||
| C. | A-Zn B-石墨 C-H2SO4 | D. | A-石墨 B-Zn C-H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com