
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
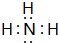 ,
,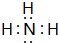 ;
;
| ||
| 冰晶石 |
| 324×103g |
| 27g/mol |
| ||
| 冰晶石 |
|


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
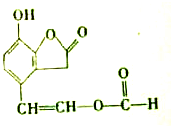
| A、M的分子式为C11H8O4 |
| B、M能发生银镜反应 |
| C、M能使FeCl3溶液呈紫色 |
| D、1mol M与足量NaOH溶液反应时,最多消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
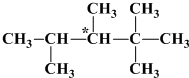

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
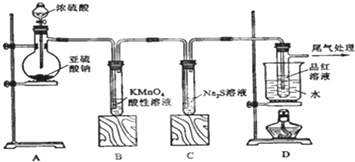
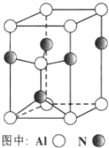 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中,加入 | 存在Fe2+ |

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com