
【题目】【2017届河北衡水中学全国高三大联考(全国卷)理科综合化学试】
下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |
【答案】C
【解析】A. 其他条件不变,缩小H2(g)+I2(g)![]() 2HI(g)的平衡体系的容器容积,碘蒸气的浓度变大,所以气体颜色变深,但是因为前后气体分子数不变,平衡不发生移动,A不正确;B. 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 ,不能确定原溶液中一定含有Fe3+ ,因为操作步骤是错误的,应该先加入KSCN溶液,观察到溶液变红才能确定,所以B不正确; C. 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失所取稀硫酸体积小于20.00mL,因为气泡的体积也计算在内,所以C正确; D. 碳酸根离子的水解分两步进行,以第一步为主,水解的离子方程式为C2O42-+H2O
2HI(g)的平衡体系的容器容积,碘蒸气的浓度变大,所以气体颜色变深,但是因为前后气体分子数不变,平衡不发生移动,A不正确;B. 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 ,不能确定原溶液中一定含有Fe3+ ,因为操作步骤是错误的,应该先加入KSCN溶液,观察到溶液变红才能确定,所以B不正确; C. 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失所取稀硫酸体积小于20.00mL,因为气泡的体积也计算在内,所以C正确; D. 碳酸根离子的水解分两步进行,以第一步为主,水解的离子方程式为C2O42-+H2O![]() HC2O4-+OH-,25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大,根据越弱越水解,可判断酸性:HC2O4-<HF,所以D不正确。
HC2O4-+OH-,25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大,根据越弱越水解,可判断酸性:HC2O4-<HF,所以D不正确。


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是
A. H+、NO3-、CO32- B. K+、Na+、SO42-
C. NH4+、OH-、SO42- D. Ag+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数(反应物已转化为产物的物质的量和反应物总物质的量的比)随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数(反应物已转化为产物的物质的量和反应物总物质的量的比)随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是

A. b代表0℃下CH3COCH3的Y-t曲线
B. 反应进行到20min末,CH3COCH3的v (0℃)/v(20℃)的比值大于1
C. 升高温度可以缩短反应达到平衡的时间并能提高反应物转化为生成物的物质的量
D. 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的Δn(0℃)/Δn(20℃)的比值等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国,使用最早的合金是_________。目前用量最大、用途最广的合金是_________,根据其化学成分,可分为_________和_________两大类。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省西安市长安区第一中学大学区2017届高三第三次联考理综】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
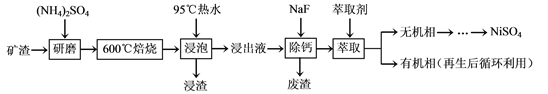
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是__________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,
加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
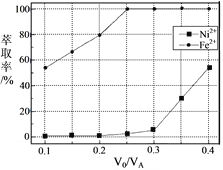
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【上海市闵行区2017届高三上学期期末教学质量调研(一模)】
利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
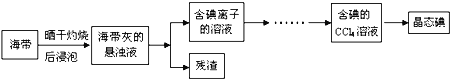
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. NaHCO3=Na++HCO3- B. KClO3=K++Cl-+3O2-
C. Ca(NO3)2=Ca2++2(NO3)2- D. 熔融状态下:NaHSO4=Na++H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com