
| A. | 标准状况下5.6L 氢气 | B. | 6.02×1022个H2SO4 | ||
| C. | 11gCO2 | D. | 4℃时9mL水 |
分析 A、根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量;
B、根据n=$\frac{N}{{N}_{A}}$;
C、根据n=$\frac{m}{M}$;
D、根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量;结合分子含有原子数目计算含有原子总物质的量,据此判断.
解答 解:A、标况下,5.6L氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,所以原子总物质的量为0.5mol;
B、6.02×1022个H2SO4的物质的量为0.1mol,所以原子总物质的量为0.7mol;
C、11gCO2的物质的量为0.25mol,所以原子总物质的量为0.75mol;
D、9mL水的质量为9g,其物质的量为0.5mol,含有原子为0.5mol×3=1.5mol;
所以4℃时9mL水所含原子总数最多,
故选D.
点评 本题考查物质的量有关计算,注意微粒数目的计算的方法,比较基础,难度中等.


科目:高中化学 来源: 题型:解答题
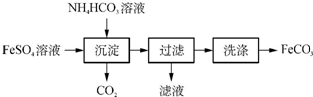
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
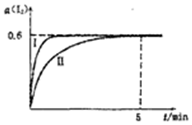 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含142gNa2SO4 | B. | 1L溶液中含有1molNa+ | ||
| C. | 将142gNa2SO4溶于1L水中配成溶液 | D. | 1L水中含有1molNa2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com