
科目:高中化学 来源: 题型:选择题
| A. | 用铜电极电解氯化钙溶液:2 Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 向碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2 HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| D. | 向偏铝酸钠溶液中加入足量的NaHSO4溶液:AlO2-+H++H2O═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | Fe(OH)2溶于稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | Fe2O3溶与足量的氢溴酸:Fe2O3+6H++2Br-═2Fe2++Br2+3H2O | |
| D. | HCl滴入NaAlO2溶液中:AlO2-+H++H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水和浓硫酸共热制备HCl气体 | |
| B. | 将H2和Cl2混合,在光照条件下反应,用于工业制备盐酸 | |
| C. | 将Cl2通入饱和石灰水,用于工业生产漂白粉 | |
| D. | 实验室用稀NaOH溶液吸收实验过程中多余的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
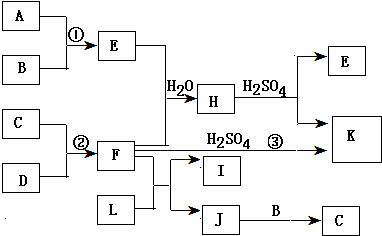
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有放热的氧化还原反应才能设计成原电池,并将电能转化为化学能 | |
| B. | 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路 | |
| C. | 无论在原电池还是在电解池中,电子均不能通过电解质溶液 | |
| D. | 原电池的负极失去电子的总数等于正极得到电子的总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com