
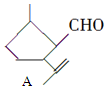
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
分析 有机物A的结构简式为 ,既有-CHO,又含有C=C,均能被氧化,应先利用弱氧化剂检验-CHO,再检验C=C双键,以此来解答.
,既有-CHO,又含有C=C,均能被氧化,应先利用弱氧化剂检验-CHO,再检验C=C双键,以此来解答.
解答 解:A.溴水的氧化性很强,会把-CHO氧化成-COOH,同时C=C与溴水发生加成,不能一一检验,故A错误;
B.在既有C=C又有-CHO的情况下,可用新制氢氧化铜(加热至沸腾),检验-CHO,再利用溴水检验C=C,故B正确;
C.在既有C=C又有-CHO的情况下,银氨溶液(水浴)可检验-CHO,再利用溴水检验C=C,故C正确;
D.酸性高锰酸钾将C=C及-CHO均氧化,不能一一检验,故D错误.
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、醛性质的考查,题目难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 提纯混有少量硝酸钾的氯化钠采用蒸发结晶,趁热过滤的方法 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
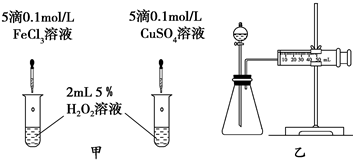
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 | |
| D. | 用KI滴定FeCl3溶液时选用淀粉作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
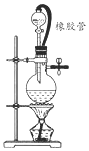 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NaOH═Na2SO3+H2O | B. | 3NO2+2H2O═2HNO3+NO | ||
| C. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中Li+向正极移动 | |
| B. | 可加入硫酸以提高电解质的导电性 | |
| C. | 充电时,Li+向阳极移动 | |
| D. | 放电时,负极反应式为:2Li0.35NiO2+Li++e-═2Li0.85NiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V3>V2>V1 | B. | V1>V2=V3 | C. | V3>V2=V1 | D. | V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com