


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
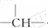 和一个-Cl,它的可能结构分别是
和一个-Cl,它的可能结构分别是查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、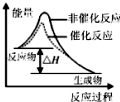 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、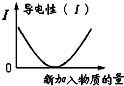 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 | 说明试液中一定含有SO42- |
| B | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 | 研究催化剂对过氧化氢分解速率的影响 |
| C | 将Na2CO3与HCl两种溶液相互滴加 | 可以鉴别这两种溶液 |
| D | C2H5Br与AgNO3溶液混合加热 | 检验C2H5Br中的溴元素 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com