
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是

A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO![]() =PbSO4
=PbSO4
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
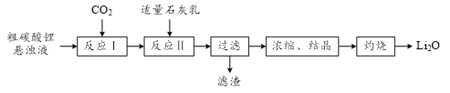
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
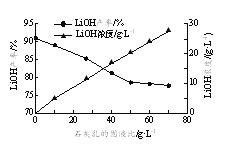
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
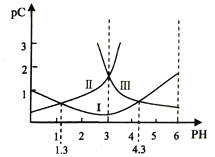
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某烷烃的键线式为![]() ,
,
①用系统命名法命名该烷烃:___________________。
②若该烷烃是由烯烃和1molH2加成得到的,则原烯烃的结构有___________种。(不包括立体异构,下同)
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(2)某有机物X由C、H、O三种元素组成,经测定其相对分子质量为90。取1.8gX在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。则有机物X的分子式为___________。已知有机物X含有一个一COOH,在1H-NMR 谱上观察氢原子给出四种特征峰,强度为3:1:1:l 。则X 的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法正确的是
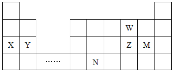
A. 简单氢化物的熔沸点W>Z,是因为W的非金属性强
B. 单核离子的半径:Y2+>X+
C. 溴与元素M同主族,最高价氧化物对应的水化物酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
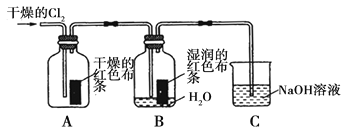
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
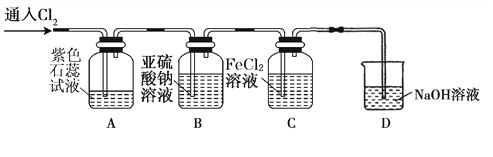
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com