
| A. | 铁离子和铜离子分离开来 | |
| B. | 铁离子和铜离子均转化为难溶的氢氧化物 | |
| C. | 流动相和固定相分离 | |
| D. | 被分离的组分呈现不同的颜色 |
分析 纸层析法分离铁离子和铜离子的实验中,滤纸作为惰性支持物,滤纸上吸附的水作为固定相,有机溶剂为展开剂,利用离子的溶解能力及随有机溶剂的移动而展开,从而达到分离的目的,通入氨气,可分别生成氢氧化铝、氢氧化铁,沉淀颜色不同,以此解答该题.
解答 解:用纸层析法分离铁离子和铜离子,在有机相的作用下,铁离子、铜离子分离,最后一步通入氨气,可分别生成氢氧化铝、氢氧化铁沉淀,颜色分别为白色、红褐色,呈现不同的颜色,只有D正确.
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握纸层析法利用在不同溶剂中的扩散速率不同分离原理为解答的关键,把握实验操作的注意事项即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | a=4b+3c | B. | a=4b+c | C. | a:b=4:1 | D. | a:b=4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>M | |
| B. | 1molW溶于足量水中完全反应其转移2mol电子 | |
| C. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定只有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
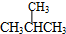 和
和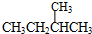 ;
;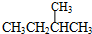 和
和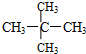 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com