
分析 (1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g),据此计算焓变;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
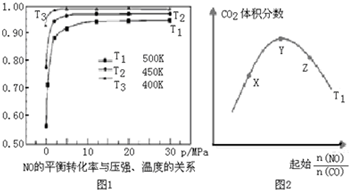
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论(4)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,据此分析;
(5)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,据此画图;
解答 解:(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4=(2c-a)KJ/mol,
故答案为:2c-a;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$,
故答案为:$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;
B.密度=$\frac{总质量}{体积}$,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
C.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故C正确;
D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;
故选CD,
故答案为:CD;
(4)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,
故答案为:常压下NO的转化率已经较高,并且高压要增加成本;
(5)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,
故答案为:Z>Y>X;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1,所以温度为T2时的变化趋势曲线为: ,
,
故答案为: ;
;
点评 本题考查了盖斯定律计算,化学反应速率、平衡常数概念理解和计算应用,图象分析方法,反应自发进行的判断依据是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O═CaSO4↓+2H++Cl-+HClO | |
| C. | 用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 在碳酸氢钙溶液中加入过量的氢氧化钙溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2,H2S,SO2 | B. | N2,Cl2,HBr | C. | CO2,O2,NO | D. | NH3,CO2,HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答:
A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答: ;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.
;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为:Zn-2e-═Zn2+ | |
| B. | 电池反应为:Zn+Cu2+═Zn2++Cu | |
| C. | 在外电路中,电子从铜电极流向锌电极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
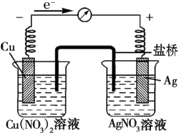 某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.
某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com