
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为________________。
(3)母液中溶质主要成分为__________。(填化学式)
(4)检验废渣中主要成分的方法:
①操作__________________________,
②现象__________________________,
③结论__________________________。
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源:2016-2017学年河南省高一12月月考化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.碘在酒精中的溶解度比在水中大,故可以用酒精萃取碘水中的碘
B.胶体的本质特征是可以产生丁达尔效应
C.BaSO4难溶于水,所以BaSO4不是电解质
D.酸性氧化物均可以和碱发生反应
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法都正确的是
①绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应
②Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化
③金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键
⑥高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一
A.①②③④ B.①②④⑥ C.①②⑤⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
A.密度比为11 :7 B.分子数比为7∶11
C.原子数比为22 ∶21 D.体积比为7∶11
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
下列物质属于电解质的一组是 ( )
( )
A. CO2、氨水、H2SO4 B.熔融NaCl 、HNO3、H2O
C. KOH、BaCl2、Cu D.KNO3、盐酸、C2H5OH
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法不正确的是
A. 最终得到的溶液中: c(NaAlO2):c(NaCl) =2:3
B. 最终得到7.8g沉淀
C. 标准状况下,反应过程中共生成8.96 L气体
D. 最终得到的溶液中: c(Na+)=2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
在含有Fe2+、Fe3+、Al3+、NH4+的稀溶液中加入Na2O2固体,充分作用后,再加入过量稀盐酸完全反应,则离子数目没有明显变化的是( )
A. Fe2+ B. Fe3+ C. Al3+ D.NH4+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
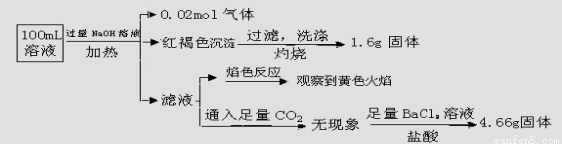
下列说法正确的是( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:填空题
(14分)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C( s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=_________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加 入一定量的活性炭和NO,发生反应C(s)+2NO(g)
入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
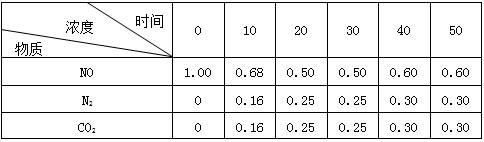
0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO
b.通入一定量的N2
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再 发生改变
发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=_________mol/L。NO的转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com